よむ、つかう、まなぶ。
資料1-3 ビソプロロール 調査結果報告書及び添付文書[2.5MB] (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38855.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第15回 3/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
・ 心不全の急性増悪:利尿薬、強心薬、血管拡張剤を静脈
内投与すること。
・ 低血圧:強心剤、昇圧剤、輸液等の投与や補助循環を適
用すること。
・ 気管支痙れん:イソプレナリン塩酸塩、β2刺激薬又はア
ミノフィリン水和物等の気管支拡張剤を投与すること。
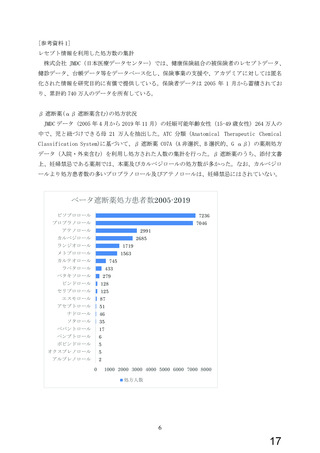
投与量の90.0±6.0%が排泄された。未変化体は47.8±10.5%で
残りは代謝産物(アルキル側鎖の開裂体及びその酸化体)で
あった4)。
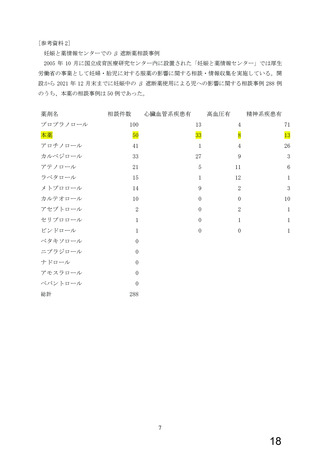
16.6 特定の背景を有する患者
16.6.1 腎あるいは肝疾患患者での血中濃度
腎疾患14例あるいは肝疾患18例の患者に本剤10mgを1日1回
7日間反復経口投与した時の血漿中濃度及び尿中への排泄率
を調べ、健康成人8例のそれと比較検討した。定常状態での
最高血中濃度及び最低血中濃度は、健康成人に比べて高く
なり、全身クリアランスの低下、半減期の延長が認められ
た7)(外国人のデータ)。
腎あるいは肝疾患患者での体内動態パラメータ
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指
導すること。PTPシートの誤飲により、硬い鋭角部が食道粘
膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併
症を併発することがある。
健康成人 中等度腎障害a 重症の腎障害b 急性肝炎 肝硬変
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 β遮断剤服用中の患者では、他の薬剤によるアナフィラキ
シー反応がより重篤になることがあり、また、通常用量の
アドレナリンによる治療では効果が得られない場合がある。
15.1.2 日本人慢性心不全患者を対象に、承認用法及び用量とは異
なる用量調節方法(1日1回0.625、1.25、2.5又は5mgの段階
で用量を増減)で実施されたプラセボ対照二重盲検比較試
験では、主要評価項目である「心血管系の原因による死亡
又は心不全悪化による入院」において本剤のプラセボに対
する優越性は示されなかった[イベント発現例数:本剤群
13/100例、プラセボ群14/100例、ハザード比(95%信頼区
間):0.93(0.44-1.97)]。このうち「心不全悪化による入院」
は本剤群12例、プラセボ群9例、「心血管系の原因による死
亡」は本剤群1例、プラセボ群5例であった1)。[1.2、7.4 参
照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人10例に本剤5mgを単回経口投与した場合、3.1±0.4
時間で最高血漿中濃度(23.7±1.0ng/mL)に達し、半減期
は8.6±0.3時間であった2)。
16.1.2 反復投与
(1)健康成人6例に本剤10mg/回/日を7日間経口投与した場合
の血漿中濃度は3~4日で定常状態に達した。
(2)本態性高血圧症患者5例に、本剤5mg1日1回朝食後、5~8
日間連続投与したとき、健康成人と比べて大差なかった3)。
16.2 吸収
16.2.1 バイオアベイラビリティ
88%4)(ビソプロロールフマル酸塩10mg静脈内投与と単回経
口投与のAUCで比較。外国人のデータ)。
16.2.2 食事の影響
健康成人6例に本剤10mgを絶食あるいは食後に経口投与し
た場合の薬物動態パラメータを比較した時、食事の影響は
なかった4)(外国人のデータ)。
16.3 分布
ヒト血清蛋白に対する結合率は26~33%であった5)(限外ろ過
法、in vitro)。
16.4 代謝
ヒトにおいて本剤の代謝は、アルキル側鎖の開裂とその酸化
的代謝産物のみである。ビソプロロールは、CYP2D6と
CYP3A4に代謝される3)、6)。
16.5 排泄
外国人のデータでは健康成人5例に14C-ビソプロロールフマル
酸塩20mgを単回経口投与したとき、投与72時間までに尿中へ
-4-
(n=8)
(n=11)
(n=3)
52±5
74±5
-
54±5
62±5
11±1
32±4
-
19±3
22±3
14.2±1.4
ンス(L/hr)
半減期(hr) 10.0±0.9
7.8±0.6
5.0±1.2
11.9±1.1 10.8±1.2
18.5±1.7
24.2±2.4
12.5±1 13.5±1.1
定常状態での
最高血中濃度
(n=5) (n=13)
(μg/L)
定常状態での
最低血中濃度
(μg/L)
全身クリアラ
Mean±SEM
a:平均クレアチニンクリアランスは28±5ml/min
b:クレアチニンクリアランスは<5ml/min
注)本剤の承認用量は1日1回0.625~5mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
〈本態性高血圧症〉
17.1.1 国内第Ⅲ相試験
本態性高血圧症患者を対象として、本剤5mg/日を1日1回、
12週間経口投与した二重盲検比較試験において、有効率は
67.8%(75/111例)であった。
副作用発現頻度は9.9%(11/111例)であった。主な副作用
は倦怠感・脱力感2.7%(3/111例)、心胸比増大、尿酸上昇
1.8%(2/111例)であった。
〈狭心症〉
17.1.2 国内第Ⅲ相試験
狭心症患者を対象として、本剤5mg/日を1日1回、2週間経
口投与した二重盲検比較試験において、有効率は79.1%
(34/43例)であった。
副作用発現頻度は8.0%(4/50例)であった。副作用の内訳
は徐脈、頭重・頭重感、倦怠感・脱力感、AST上昇いずれ
も2.0%(1/50例)であった。
〈心室性期外収縮〉
17.1.3 国内第Ⅲ相試験
心室性期外収縮患者を対象として、本剤5mg/日を1日1回、
2週間経口投与した二重盲検比較試験において、有効率は
57.1%(28/49例)であった。
〈頻脈性心房細動〉
17.1.4 国内第Ⅲ相試験
慢性(持続性・永続性)心房細動患者を対象に、本剤
2.5mg/日を2週間投与(第1期:非盲検・非対照)、その後、
増量が必要と判断された被験者に対し本剤2.5mg/日、5mg/
日のいずれかに割付け、更に2週間投与した(第2期:ラン
ダム化・二重盲検・並行群間比較)。
本剤2.5mg/日投与群において、第1期終了時の24時間ホル
ター心電図の平均心拍数(Mean±SD)は、投与開始前と
比較して有意な低下が見られた。
増量が必要と判断された被験者の治療期間(第1期及び第2
期)における本剤5mg/日投与群の24時間ホルター心電図の
平均心拍数は、第1期投与開始前と比較して第2期終了時で
は有意な低下が見られた8)。
52
内投与すること。
・ 低血圧:強心剤、昇圧剤、輸液等の投与や補助循環を適
用すること。
・ 気管支痙れん:イソプレナリン塩酸塩、β2刺激薬又はア
ミノフィリン水和物等の気管支拡張剤を投与すること。
投与量の90.0±6.0%が排泄された。未変化体は47.8±10.5%で
残りは代謝産物(アルキル側鎖の開裂体及びその酸化体)で
あった4)。
16.6 特定の背景を有する患者
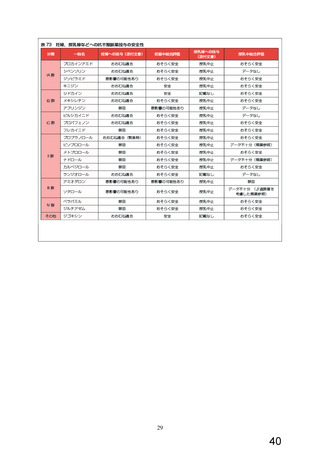
16.6.1 腎あるいは肝疾患患者での血中濃度
腎疾患14例あるいは肝疾患18例の患者に本剤10mgを1日1回
7日間反復経口投与した時の血漿中濃度及び尿中への排泄率
を調べ、健康成人8例のそれと比較検討した。定常状態での
最高血中濃度及び最低血中濃度は、健康成人に比べて高く
なり、全身クリアランスの低下、半減期の延長が認められ
た7)(外国人のデータ)。
腎あるいは肝疾患患者での体内動態パラメータ
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指
導すること。PTPシートの誤飲により、硬い鋭角部が食道粘
膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併
症を併発することがある。
健康成人 中等度腎障害a 重症の腎障害b 急性肝炎 肝硬変
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 β遮断剤服用中の患者では、他の薬剤によるアナフィラキ
シー反応がより重篤になることがあり、また、通常用量の
アドレナリンによる治療では効果が得られない場合がある。
15.1.2 日本人慢性心不全患者を対象に、承認用法及び用量とは異
なる用量調節方法(1日1回0.625、1.25、2.5又は5mgの段階
で用量を増減)で実施されたプラセボ対照二重盲検比較試
験では、主要評価項目である「心血管系の原因による死亡
又は心不全悪化による入院」において本剤のプラセボに対
する優越性は示されなかった[イベント発現例数:本剤群
13/100例、プラセボ群14/100例、ハザード比(95%信頼区
間):0.93(0.44-1.97)]。このうち「心不全悪化による入院」
は本剤群12例、プラセボ群9例、「心血管系の原因による死
亡」は本剤群1例、プラセボ群5例であった1)。[1.2、7.4 参
照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人10例に本剤5mgを単回経口投与した場合、3.1±0.4
時間で最高血漿中濃度(23.7±1.0ng/mL)に達し、半減期
は8.6±0.3時間であった2)。
16.1.2 反復投与
(1)健康成人6例に本剤10mg/回/日を7日間経口投与した場合
の血漿中濃度は3~4日で定常状態に達した。
(2)本態性高血圧症患者5例に、本剤5mg1日1回朝食後、5~8
日間連続投与したとき、健康成人と比べて大差なかった3)。
16.2 吸収
16.2.1 バイオアベイラビリティ
88%4)(ビソプロロールフマル酸塩10mg静脈内投与と単回経
口投与のAUCで比較。外国人のデータ)。
16.2.2 食事の影響
健康成人6例に本剤10mgを絶食あるいは食後に経口投与し
た場合の薬物動態パラメータを比較した時、食事の影響は
なかった4)(外国人のデータ)。
16.3 分布
ヒト血清蛋白に対する結合率は26~33%であった5)(限外ろ過
法、in vitro)。
16.4 代謝
ヒトにおいて本剤の代謝は、アルキル側鎖の開裂とその酸化
的代謝産物のみである。ビソプロロールは、CYP2D6と
CYP3A4に代謝される3)、6)。
16.5 排泄
外国人のデータでは健康成人5例に14C-ビソプロロールフマル
酸塩20mgを単回経口投与したとき、投与72時間までに尿中へ
-4-
(n=8)
(n=11)
(n=3)
52±5
74±5
-
54±5
62±5
11±1
32±4
-
19±3
22±3
14.2±1.4
ンス(L/hr)
半減期(hr) 10.0±0.9
7.8±0.6
5.0±1.2
11.9±1.1 10.8±1.2
18.5±1.7
24.2±2.4
12.5±1 13.5±1.1
定常状態での
最高血中濃度
(n=5) (n=13)
(μg/L)
定常状態での
最低血中濃度
(μg/L)
全身クリアラ
Mean±SEM
a:平均クレアチニンクリアランスは28±5ml/min
b:クレアチニンクリアランスは<5ml/min
注)本剤の承認用量は1日1回0.625~5mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
〈本態性高血圧症〉
17.1.1 国内第Ⅲ相試験
本態性高血圧症患者を対象として、本剤5mg/日を1日1回、
12週間経口投与した二重盲検比較試験において、有効率は
67.8%(75/111例)であった。
副作用発現頻度は9.9%(11/111例)であった。主な副作用
は倦怠感・脱力感2.7%(3/111例)、心胸比増大、尿酸上昇
1.8%(2/111例)であった。
〈狭心症〉
17.1.2 国内第Ⅲ相試験
狭心症患者を対象として、本剤5mg/日を1日1回、2週間経
口投与した二重盲検比較試験において、有効率は79.1%
(34/43例)であった。
副作用発現頻度は8.0%(4/50例)であった。副作用の内訳
は徐脈、頭重・頭重感、倦怠感・脱力感、AST上昇いずれ
も2.0%(1/50例)であった。
〈心室性期外収縮〉
17.1.3 国内第Ⅲ相試験
心室性期外収縮患者を対象として、本剤5mg/日を1日1回、
2週間経口投与した二重盲検比較試験において、有効率は
57.1%(28/49例)であった。
〈頻脈性心房細動〉
17.1.4 国内第Ⅲ相試験
慢性(持続性・永続性)心房細動患者を対象に、本剤
2.5mg/日を2週間投与(第1期:非盲検・非対照)、その後、
増量が必要と判断された被験者に対し本剤2.5mg/日、5mg/
日のいずれかに割付け、更に2週間投与した(第2期:ラン
ダム化・二重盲検・並行群間比較)。
本剤2.5mg/日投与群において、第1期終了時の24時間ホル
ター心電図の平均心拍数(Mean±SD)は、投与開始前と
比較して有意な低下が見られた。
増量が必要と判断された被験者の治療期間(第1期及び第2
期)における本剤5mg/日投与群の24時間ホルター心電図の
平均心拍数は、第1期投与開始前と比較して第2期終了時で
は有意な低下が見られた8)。
52