よむ、つかう、まなぶ。
資料1-3 ビソプロロール 調査結果報告書及び添付文書[2.5MB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38855.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第15回 3/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
調査結果報告書
令和 6 年 2 月 1 日
独立行政法人医薬品医療機器総合機構
I.
品目の概要
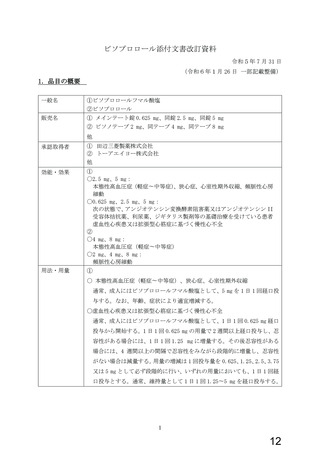
[一 般 名]
①ビソプロロールフマル酸塩、②ビソプロロール
[販 売 名]
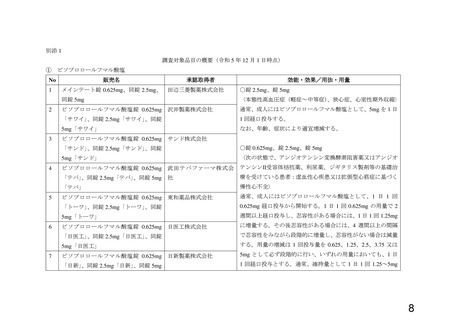
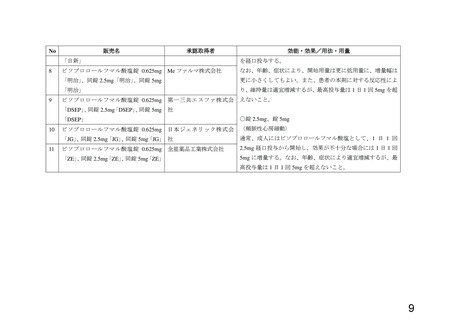
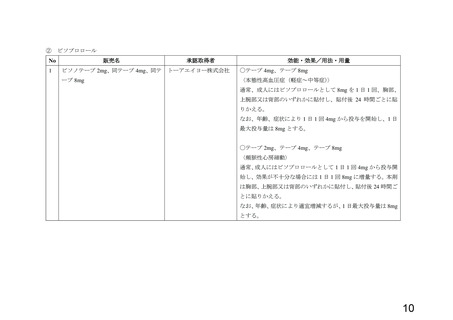
別添 1 のとおり
[承認取得者] 別添 1 のとおり
[効能・効果] 別添 1 のとおり
[用法・用量] 別添 1 のとおり
[調査担当部] 医薬品安全対策第一部
II. 今回の調査の経緯
厚生労働省は、
「妊婦・授乳婦を対象とした薬の適正使用推進事業」1において、医師、薬
剤師、動物試験の専門家等で構成される情報提供ワーキンググループ(以下、
「WG」
)を設
置し、国立成育医療研究センターの妊娠と薬情報センターに集積された情報等を評価・整理
し、妊婦・授乳婦への医薬品投与に関する情報の添付文書への反映を推進する取組を行って
いる。
ビソプロロールフマル酸塩及びビソプロロール(以下、両成分を合わせて「本薬」)につ
いては、「妊婦又は妊娠している可能性のある女性」は禁忌に設定されている。これは、動
物実験で胎児毒性(致死、発育抑制)及び新生児毒性(発育毒性等)が報告されていたこと
から、先発医薬品の初回承認時(ビソプロロールフマル酸塩:1990 年 9 月、ビソプロロー
ル:2013 年 6 月)より、妊婦又は妊娠している可能性のある女性には投与しないこととさ
れたものである。
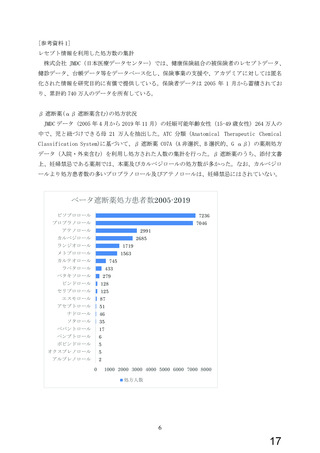
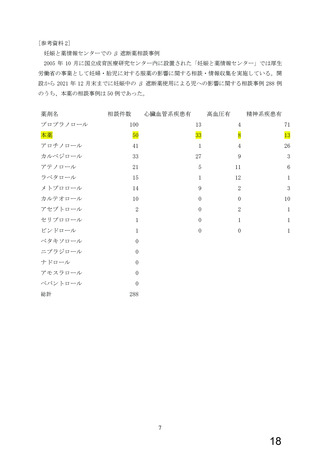
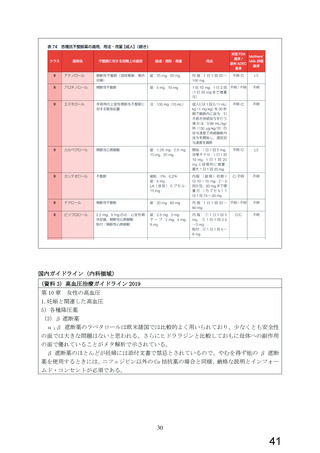
今般、WG により、β 遮断薬(αβ 遮断薬含む)のうち、虚血性心疾患又は拡張型心筋症に
基づく慢性心不全の適応を有し、収縮不全を伴う心不全や頻脈性心房細動への使用が推奨
されている本薬について、添付文書の禁忌「妊婦又は妊娠している可能性のある女性」の適
正性が検討され、報告書(以下、
「WG 報告書」
)
(別添 2)が取りまとめられた。WG 報告書
を受けて、厚生労働省医薬・生活衛生局医薬安全対策課は、
「医薬品等の安全性に係る調査
依頼について」
(令和 5 年 7 月 31 日付薬生安発 0731 第 1 号)により独立行政法人医薬品医
療機器総合機構(以下、
「機構」
)に 本薬の妊産婦等に係る「使用上の注意」の改訂に関する
調査を依頼した。機構は、当該依頼に基づく調査及び添付文書改訂の必要性の検討を行った。
1 厚生労働省ウェブページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/ninshin_00002.html)
(最終確認:2023 年 9 月 26 日)
1
令和 6 年 2 月 1 日
独立行政法人医薬品医療機器総合機構
I.
品目の概要
[一 般 名]
①ビソプロロールフマル酸塩、②ビソプロロール
[販 売 名]
別添 1 のとおり
[承認取得者] 別添 1 のとおり
[効能・効果] 別添 1 のとおり
[用法・用量] 別添 1 のとおり
[調査担当部] 医薬品安全対策第一部
II. 今回の調査の経緯
厚生労働省は、
「妊婦・授乳婦を対象とした薬の適正使用推進事業」1において、医師、薬
剤師、動物試験の専門家等で構成される情報提供ワーキンググループ(以下、
「WG」
)を設
置し、国立成育医療研究センターの妊娠と薬情報センターに集積された情報等を評価・整理
し、妊婦・授乳婦への医薬品投与に関する情報の添付文書への反映を推進する取組を行って
いる。
ビソプロロールフマル酸塩及びビソプロロール(以下、両成分を合わせて「本薬」)につ
いては、「妊婦又は妊娠している可能性のある女性」は禁忌に設定されている。これは、動
物実験で胎児毒性(致死、発育抑制)及び新生児毒性(発育毒性等)が報告されていたこと
から、先発医薬品の初回承認時(ビソプロロールフマル酸塩:1990 年 9 月、ビソプロロー
ル:2013 年 6 月)より、妊婦又は妊娠している可能性のある女性には投与しないこととさ
れたものである。
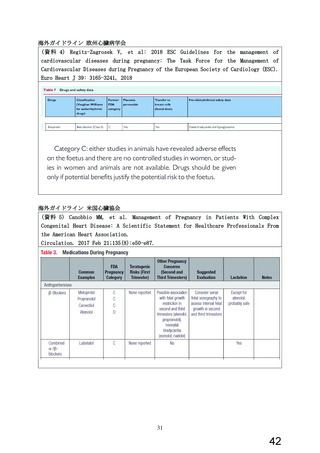
今般、WG により、β 遮断薬(αβ 遮断薬含む)のうち、虚血性心疾患又は拡張型心筋症に
基づく慢性心不全の適応を有し、収縮不全を伴う心不全や頻脈性心房細動への使用が推奨
されている本薬について、添付文書の禁忌「妊婦又は妊娠している可能性のある女性」の適
正性が検討され、報告書(以下、
「WG 報告書」
)
(別添 2)が取りまとめられた。WG 報告書
を受けて、厚生労働省医薬・生活衛生局医薬安全対策課は、
「医薬品等の安全性に係る調査
依頼について」
(令和 5 年 7 月 31 日付薬生安発 0731 第 1 号)により独立行政法人医薬品医
療機器総合機構(以下、
「機構」
)に 本薬の妊産婦等に係る「使用上の注意」の改訂に関する
調査を依頼した。機構は、当該依頼に基づく調査及び添付文書改訂の必要性の検討を行った。
1 厚生労働省ウェブページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/ninshin_00002.html)
(最終確認:2023 年 9 月 26 日)
1