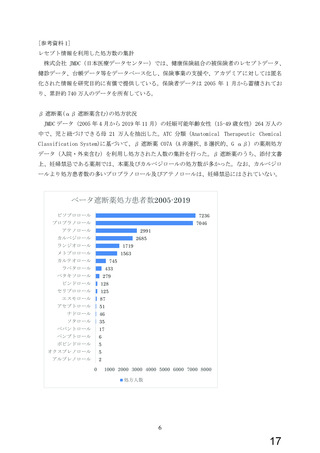
よむ、つかう、まなぶ。
資料1-3 ビソプロロール 調査結果報告書及び添付文書[2.5MB] (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38855.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第15回 3/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
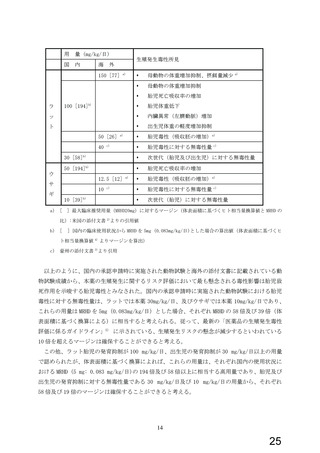
4.動物試験
本薬の先発医薬品の承認申請時にはラット及びウサギを用いた生殖発生毒性試験 1)が実施され
ており、主な生殖発生毒性所見は下記のとおりである。
ラットを用いた胎児器官形成期投与試験では、母動物に体重増加抑制がみられた本薬 100mg/kg/
日の用量において、胎児の死亡・吸収率の増加、胎児の低体重、胎児の内臓異常(左臍動脈)の増
加が認められた。また、出生児においても本薬 100mg/kg/日の用量で軽度な体重増加抑制が認めら
れた。しかし、本薬 30mg/kg/日の用量では、胎児、出生児とも薬物投与による影響は認められな
かった。生殖毒性に対する無毒性量は 100 mg/kg/日、 次世代(胎児及び出生児)に対する無毒性
量は 30 mg/kg/日であった。
ウサギを用いた胎児器官形成期投与試験において、本薬 50mg/kg/日 の用量で胎児の死亡・吸収
率の増加が認められたが、本薬 10mg/kg/日の用量では胎児に薬物投与による影響はみられなかっ
た。生殖毒性に対する無毒性量は 50 mg/kg/日、 次世代(胎児)に対する無毒性量は 10 mg/kg/
日であった。
ラットを用いた周産期及び授乳期投与試験では、本薬 30mg/kg/日 及び本薬 100mg/kg/日で F1
出生児の低体重及び交尾率の低下がみられたが、出生児の生存率、外形分化、機能の発達に薬物
投与の影響は認められなかった。本薬 10mg/kg/日の用量ではいずれの項目においても影響は認め
られなかった。生殖毒性に対する無毒性量は 100 mg/kg/日、 次世代(出生児)に対する無毒性量
は 10 mg/kg/日であった。
以上より、本薬の生殖発生に及ぼす毒性影響は、ラット及びウサギにおける高用量での胎児毒
性(胚・胎児致死、発育抑制)とラット出生児への発育抑制であると考えられた。
一方、米国の添付文書 2) に記載されている動物試験の成績によれば、ラットの試験において本
薬 150mg/kg/日の用量では母動物毒性(摂餌量減少及び体重増加抑制)がみられたが、催奇形作用
は認められなかった。この用量は、最大推奨臨床用量(MRHD)の 77 倍(体表面積に基づくヒト相
当量換算による)に相当する用量である。しかし、MRHD の 26 倍に相当する 50 mg/kg/日の用量で
ラットに胎児毒性(吸収胚の増加)が認められた。ウサギを用いた試験では MRHD の 12 倍に相当
する 12.5mg/kg/日の用量においても催奇形作用はみられなかったが、この用量で胎児毒性(吸収
胚の増加)が認められた。なお、米国添付文書における MRHD を 20 mg (0.4 mg/kg/日)として算
出されている。
豪州の添付文書 3) においては、妊娠ラットで本薬 50 mg/kg/日以上、妊娠ウサギで本薬
12.5mg/kg/日以上の用量で胎児毒性、胚吸収及び流産が認められ、胎児毒性及び致死作用に対す
る無毒性量はラットで本薬 40 mg/kg/日、ウサギでは本薬 10 mg/kg/日であると記載されている。
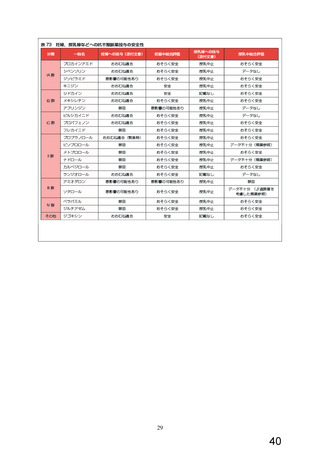
本薬の申請時に実施された胎児器官形成期投与試験成績と海外の添付文書に記載されている試
験成績を下表にまとめた。なお、国内の臨床使用状況を考慮した MRHD に対するマージンを算出す
る場合には、MRHD として 5mg (0.083mg/kg/日)
(体表面積に基づくヒト相当量換算値 4)を用い
た。
13
24
本薬の先発医薬品の承認申請時にはラット及びウサギを用いた生殖発生毒性試験 1)が実施され
ており、主な生殖発生毒性所見は下記のとおりである。
ラットを用いた胎児器官形成期投与試験では、母動物に体重増加抑制がみられた本薬 100mg/kg/
日の用量において、胎児の死亡・吸収率の増加、胎児の低体重、胎児の内臓異常(左臍動脈)の増
加が認められた。また、出生児においても本薬 100mg/kg/日の用量で軽度な体重増加抑制が認めら
れた。しかし、本薬 30mg/kg/日の用量では、胎児、出生児とも薬物投与による影響は認められな
かった。生殖毒性に対する無毒性量は 100 mg/kg/日、 次世代(胎児及び出生児)に対する無毒性
量は 30 mg/kg/日であった。
ウサギを用いた胎児器官形成期投与試験において、本薬 50mg/kg/日 の用量で胎児の死亡・吸収
率の増加が認められたが、本薬 10mg/kg/日の用量では胎児に薬物投与による影響はみられなかっ
た。生殖毒性に対する無毒性量は 50 mg/kg/日、 次世代(胎児)に対する無毒性量は 10 mg/kg/
日であった。
ラットを用いた周産期及び授乳期投与試験では、本薬 30mg/kg/日 及び本薬 100mg/kg/日で F1
出生児の低体重及び交尾率の低下がみられたが、出生児の生存率、外形分化、機能の発達に薬物
投与の影響は認められなかった。本薬 10mg/kg/日の用量ではいずれの項目においても影響は認め
られなかった。生殖毒性に対する無毒性量は 100 mg/kg/日、 次世代(出生児)に対する無毒性量
は 10 mg/kg/日であった。
以上より、本薬の生殖発生に及ぼす毒性影響は、ラット及びウサギにおける高用量での胎児毒
性(胚・胎児致死、発育抑制)とラット出生児への発育抑制であると考えられた。
一方、米国の添付文書 2) に記載されている動物試験の成績によれば、ラットの試験において本
薬 150mg/kg/日の用量では母動物毒性(摂餌量減少及び体重増加抑制)がみられたが、催奇形作用
は認められなかった。この用量は、最大推奨臨床用量(MRHD)の 77 倍(体表面積に基づくヒト相
当量換算による)に相当する用量である。しかし、MRHD の 26 倍に相当する 50 mg/kg/日の用量で
ラットに胎児毒性(吸収胚の増加)が認められた。ウサギを用いた試験では MRHD の 12 倍に相当
する 12.5mg/kg/日の用量においても催奇形作用はみられなかったが、この用量で胎児毒性(吸収
胚の増加)が認められた。なお、米国添付文書における MRHD を 20 mg (0.4 mg/kg/日)として算
出されている。
豪州の添付文書 3) においては、妊娠ラットで本薬 50 mg/kg/日以上、妊娠ウサギで本薬
12.5mg/kg/日以上の用量で胎児毒性、胚吸収及び流産が認められ、胎児毒性及び致死作用に対す
る無毒性量はラットで本薬 40 mg/kg/日、ウサギでは本薬 10 mg/kg/日であると記載されている。
本薬の申請時に実施された胎児器官形成期投与試験成績と海外の添付文書に記載されている試
験成績を下表にまとめた。なお、国内の臨床使用状況を考慮した MRHD に対するマージンを算出す
る場合には、MRHD として 5mg (0.083mg/kg/日)
(体表面積に基づくヒト相当量換算値 4)を用い
た。
13
24