よむ、つかう、まなぶ。
参考資料1:臨床研究中核病院概要表 (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
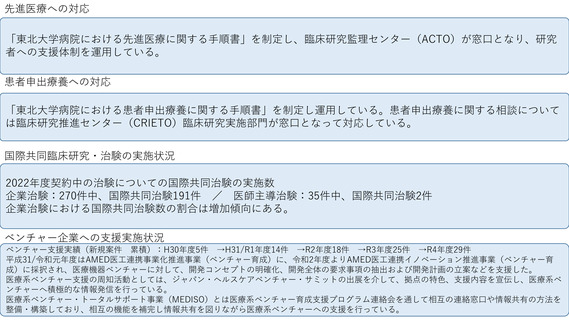
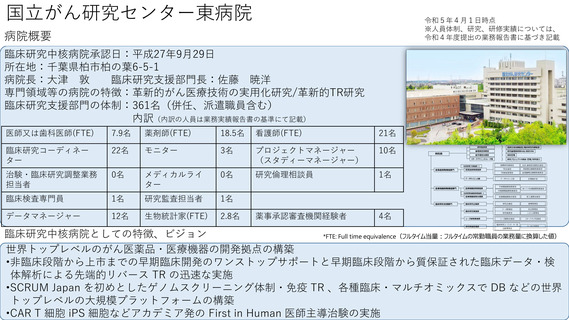
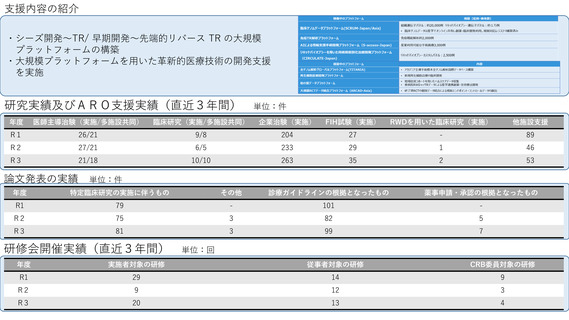
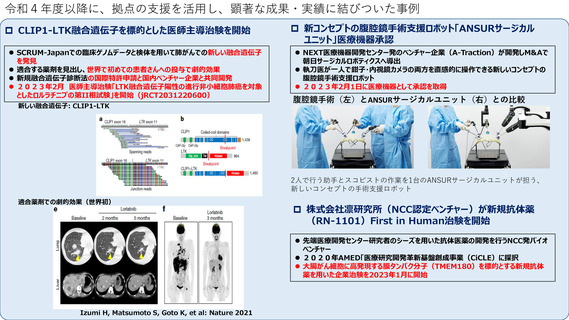
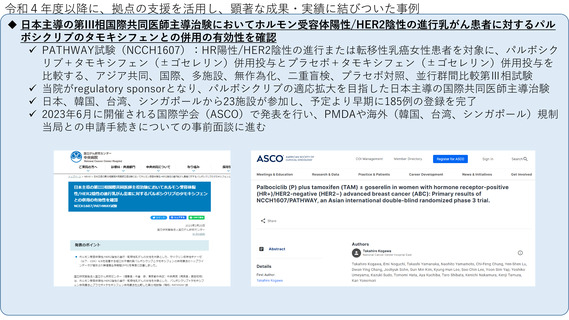
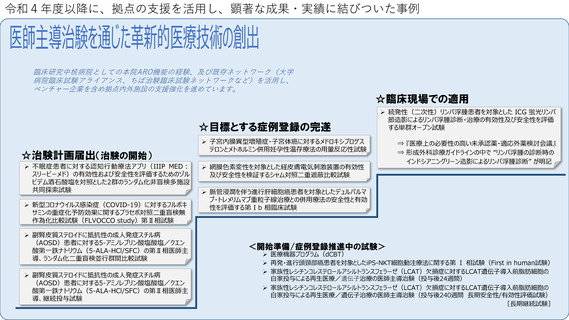
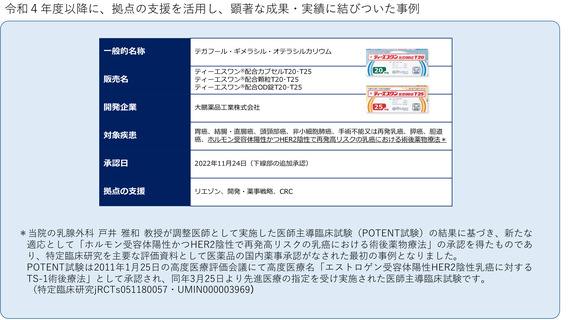
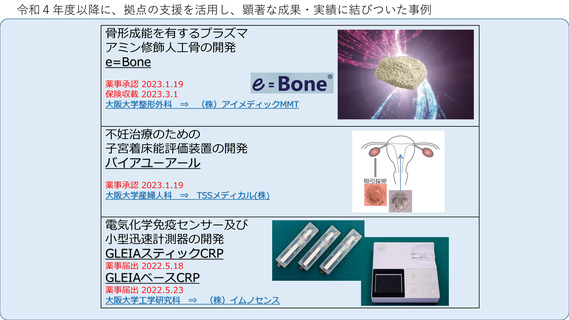
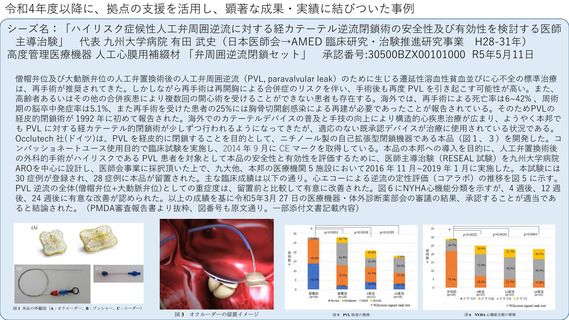
令和4年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
症候性先天性サイトメガロウイルス感染児を対象としたバルガンシクロビル塩酸塩ドライシロップの有効性および
安全性を評価し、適応拡大を目的とした医師主導多施設共同治験を、本院が代表施設として全国6大学病院で2020年
2月より実施した。
症候性先天性サイトメガロウイルス感染症は、サイトメガロウイルスが妊婦の胎盤を経由して胎児に感染し発症す
る疾患であり、国内では年間1,700人程度が発症する希少疾患である。この感染症に罹患した新生児は、出生時に中
枢神経障害や難聴などの症状を呈し、その後精神発達遅延などの神経学的な後遺症を残す割合が高く、成長や発達を
損なわせることが問題になっている。しかしながら、今まで国内外において治療薬はなく、早期に治療法を確立する
ことが望まれていた。
本医師主導治験の計画段階(2018年)から、本院臨床研究推進センターが企業交渉、PMDAの対面助言、各種必
須文書の作成、IRB申請サポート、治験の実施・終了の手続き、治験の進捗管理等を支援することにより、治験全体
のスムーズな遂行と各実施医療機関への十分な支援を行った。特に、症例登録の促進のために、治験調整医師と検
討・協業し、本治験のホームページの開設、プレスリリース、ポスター作成、学会ホームページへの掲載や学会員へ
の周知、新聞・雑誌への記事の掲載等の対応を行うことで,症例登録期間を半分に短縮することができた。その結果、
当初予定していた期間よりも早く治験結果を企業に提供することができた。
また、治験終了後も、企業による希少疾病医薬品(オーファン・ドラッグ)申請や薬事承認申請するにあたり、企
業から本院臨床研究推進センターの支援を希望されたため、希少疾病医薬品申請書類や薬事承認申請書類の確認や
PMDAからの照会事項の対応等に関する支援に加えて、適合性書面調査・実地調査の支援も実施し、2023年3月に薬
事承認を取得した(既製品のため即時保険適応となった)。(抗サイトメガロウイルス化学療法剤「バリキサドライ
シロップ5000mg」日本における症候性先天性サイトメガロウイルス感染症の適応追加承認を取得 | 田辺三菱製薬株
式会社 (mt-pharma.co.jp) )。AMEDからの研究費支援を受けて医師主導治験を実施し、難渋している本疾患の治療
に貢献できたことは、臨床研究中核病院としての誇りである。
症候性先天性サイトメガロウイルス感染児を対象としたバルガンシクロビル塩酸塩ドライシロップの有効性および
安全性を評価し、適応拡大を目的とした医師主導多施設共同治験を、本院が代表施設として全国6大学病院で2020年
2月より実施した。
症候性先天性サイトメガロウイルス感染症は、サイトメガロウイルスが妊婦の胎盤を経由して胎児に感染し発症す
る疾患であり、国内では年間1,700人程度が発症する希少疾患である。この感染症に罹患した新生児は、出生時に中
枢神経障害や難聴などの症状を呈し、その後精神発達遅延などの神経学的な後遺症を残す割合が高く、成長や発達を
損なわせることが問題になっている。しかしながら、今まで国内外において治療薬はなく、早期に治療法を確立する
ことが望まれていた。
本医師主導治験の計画段階(2018年)から、本院臨床研究推進センターが企業交渉、PMDAの対面助言、各種必
須文書の作成、IRB申請サポート、治験の実施・終了の手続き、治験の進捗管理等を支援することにより、治験全体
のスムーズな遂行と各実施医療機関への十分な支援を行った。特に、症例登録の促進のために、治験調整医師と検
討・協業し、本治験のホームページの開設、プレスリリース、ポスター作成、学会ホームページへの掲載や学会員へ
の周知、新聞・雑誌への記事の掲載等の対応を行うことで,症例登録期間を半分に短縮することができた。その結果、
当初予定していた期間よりも早く治験結果を企業に提供することができた。
また、治験終了後も、企業による希少疾病医薬品(オーファン・ドラッグ)申請や薬事承認申請するにあたり、企
業から本院臨床研究推進センターの支援を希望されたため、希少疾病医薬品申請書類や薬事承認申請書類の確認や
PMDAからの照会事項の対応等に関する支援に加えて、適合性書面調査・実地調査の支援も実施し、2023年3月に薬
事承認を取得した(既製品のため即時保険適応となった)。(抗サイトメガロウイルス化学療法剤「バリキサドライ
シロップ5000mg」日本における症候性先天性サイトメガロウイルス感染症の適応追加承認を取得 | 田辺三菱製薬株
式会社 (mt-pharma.co.jp) )。AMEDからの研究費支援を受けて医師主導治験を実施し、難渋している本疾患の治療
に貢献できたことは、臨床研究中核病院としての誇りである。