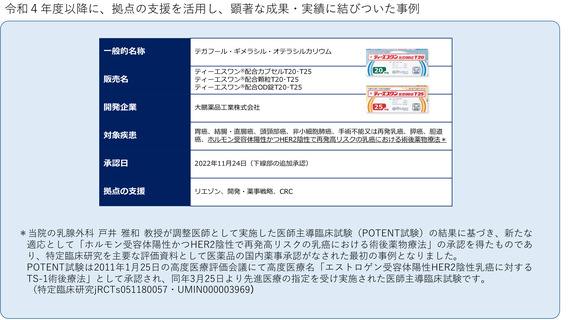
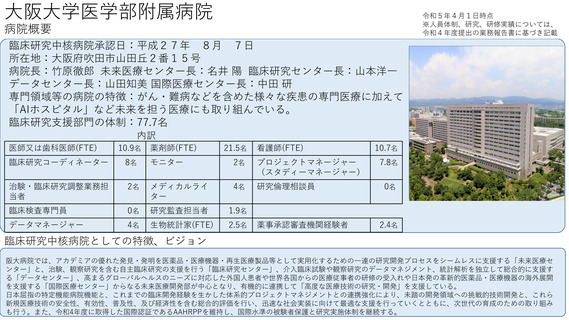
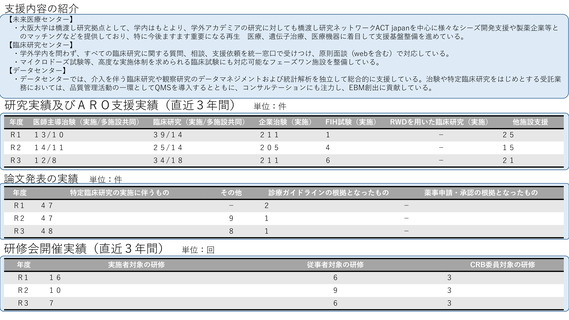
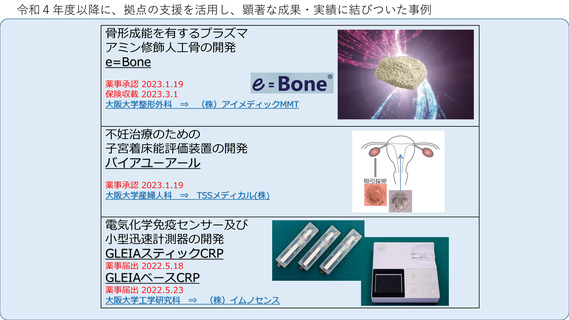
よむ、つかう、まなぶ。
参考資料1:臨床研究中核病院概要表 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
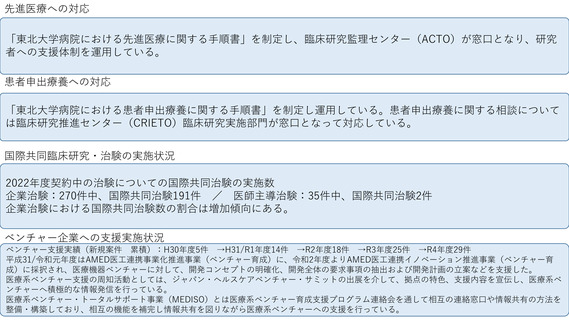
先進医療への対応
先進医療の実施の際は、臨床研究推進センター臨床研究企画推進部門が一元的な対応窓口として、最初に研究者に対する先進医療全般に関するコンサ
ルテーションを実施した後、研究デザイン、統計デザイン、実施体制の妥当性、各種事務手続き等、具体的かつ詳細な対応が必要な場合は、同セン
ター臨床研究支援部門(モニタリングユニット、データマネジメントユニット、PMOユニット、薬事管理ユニット)、生物統計部門、TR部門、再生
医療等支援部門、および臨床研究監理センター研究基盤部門等の専門部門と連携し、研究計画書及び各種資料の作成、実施・運営を支援しています。
患者申出療養への対応
患者から該当する療法の施行希望があった場合は、安全性・有効性等の確認及び保険収載に向けた実施計画の作成が可能か院内で慎重に検討し判断し
ています。その検討結果、実施計画の作成が可能と判断された場合は、臨床研究推進センター内の特定臨床研究に関わる部門である臨床研究企画推進
部門、臨床研究支援部門(モニタリングユニット、データマネジメントユニット、PMOユニット)、生物統計部門および臨床研究監理センター研究
基盤部門等が連携し、研究計画書及び各種資料の作成、運営、実施を支援することで、困難な病気と闘う患者の思いに応え、先進的な医療を迅速にう
けられる体制を整備しています。
これまでに当院の患者が申し出られた3件の患者申出療養の実施が国に承認されました。
国際共同臨床研究・治験の実施状況
日本発の革新的医薬品、医療機器等及び医療技術の開発等に必要となる質の高い臨床研究や治験を推進するため、国際水準の臨床研究や医師主導治験
の中心的な役割を担うことが求められており、海外の研究機関等と連携した国際共同臨床研究・治験についても主導的な役割を果たしています。具体
的には、海外アカデミアと共同研究開発等の連携強化を図り、国際推進拠点との積極的な協力・連携を進めています。また、海外AROとの連携も進め
ています。世界的に健康データの収集が進む中、今後、わが国のアカデミアにおいても医療データとの融合やAIの応用により、革新的な医療技術やシ
ステムが次々に開発され実用化に至ることが見込まれますので、海外展開を実施しているIT企業やベンダー、アウトバウンド事業を推進している病院
等と連携してそれを強化し、国際展開を視野に入れた新たなシーズ開発を進められる体制の構築を進めています。
ベンチャー企業への支援実施状況
・2017年8月、臨床研究推進センターHPに医療系ベンチャー育成支援の問い合わせ・相談窓口を設置し、橋渡し研究シーズをもとに起業したベンチャーを中心に支援を行って
います。慶應義塾大学医学部発ベンチャー協議会の後援組織として、学内発ベンチャーの支援の強化に取り組む体制を整備しました。
・臨床研究推進センターと、学校法人慶應義塾の研究連携推進本部やイノベーション推進本部との連携・役割分担等についても、定期的な情報交換を通じて協議を行っていま
す。
・2018年より毎年10月開催のJapan Healthcare Venture Summit (JHVS)に参加し、臨床研究中核病院におけるベンチャー支援に関する発表や拠点紹介を行っています。
・2019年度より3年間、「医療系ベンチャー育成支援」の取りまとめ機関として、年4−5回の連絡会を開催し、臨床研究中核病院間の情報共有、JHVSへの参加、MEDISOとの
連携等につき推進してきました。
先進医療の実施の際は、臨床研究推進センター臨床研究企画推進部門が一元的な対応窓口として、最初に研究者に対する先進医療全般に関するコンサ
ルテーションを実施した後、研究デザイン、統計デザイン、実施体制の妥当性、各種事務手続き等、具体的かつ詳細な対応が必要な場合は、同セン
ター臨床研究支援部門(モニタリングユニット、データマネジメントユニット、PMOユニット、薬事管理ユニット)、生物統計部門、TR部門、再生
医療等支援部門、および臨床研究監理センター研究基盤部門等の専門部門と連携し、研究計画書及び各種資料の作成、実施・運営を支援しています。
患者申出療養への対応
患者から該当する療法の施行希望があった場合は、安全性・有効性等の確認及び保険収載に向けた実施計画の作成が可能か院内で慎重に検討し判断し
ています。その検討結果、実施計画の作成が可能と判断された場合は、臨床研究推進センター内の特定臨床研究に関わる部門である臨床研究企画推進
部門、臨床研究支援部門(モニタリングユニット、データマネジメントユニット、PMOユニット)、生物統計部門および臨床研究監理センター研究
基盤部門等が連携し、研究計画書及び各種資料の作成、運営、実施を支援することで、困難な病気と闘う患者の思いに応え、先進的な医療を迅速にう
けられる体制を整備しています。
これまでに当院の患者が申し出られた3件の患者申出療養の実施が国に承認されました。
国際共同臨床研究・治験の実施状況
日本発の革新的医薬品、医療機器等及び医療技術の開発等に必要となる質の高い臨床研究や治験を推進するため、国際水準の臨床研究や医師主導治験
の中心的な役割を担うことが求められており、海外の研究機関等と連携した国際共同臨床研究・治験についても主導的な役割を果たしています。具体
的には、海外アカデミアと共同研究開発等の連携強化を図り、国際推進拠点との積極的な協力・連携を進めています。また、海外AROとの連携も進め
ています。世界的に健康データの収集が進む中、今後、わが国のアカデミアにおいても医療データとの融合やAIの応用により、革新的な医療技術やシ
ステムが次々に開発され実用化に至ることが見込まれますので、海外展開を実施しているIT企業やベンダー、アウトバウンド事業を推進している病院
等と連携してそれを強化し、国際展開を視野に入れた新たなシーズ開発を進められる体制の構築を進めています。
ベンチャー企業への支援実施状況
・2017年8月、臨床研究推進センターHPに医療系ベンチャー育成支援の問い合わせ・相談窓口を設置し、橋渡し研究シーズをもとに起業したベンチャーを中心に支援を行って
います。慶應義塾大学医学部発ベンチャー協議会の後援組織として、学内発ベンチャーの支援の強化に取り組む体制を整備しました。
・臨床研究推進センターと、学校法人慶應義塾の研究連携推進本部やイノベーション推進本部との連携・役割分担等についても、定期的な情報交換を通じて協議を行っていま
す。
・2018年より毎年10月開催のJapan Healthcare Venture Summit (JHVS)に参加し、臨床研究中核病院におけるベンチャー支援に関する発表や拠点紹介を行っています。
・2019年度より3年間、「医療系ベンチャー育成支援」の取りまとめ機関として、年4−5回の連絡会を開催し、臨床研究中核病院間の情報共有、JHVSへの参加、MEDISOとの
連携等につき推進してきました。