よむ、つかう、まなぶ。
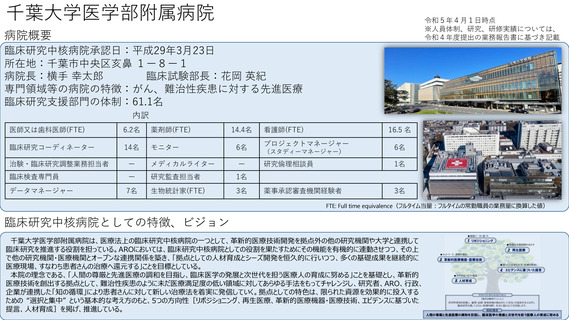
参考資料1:臨床研究中核病院概要表 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
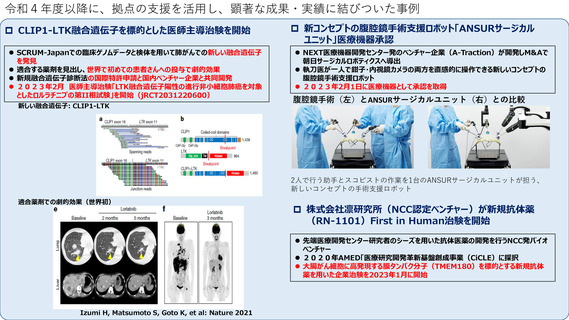
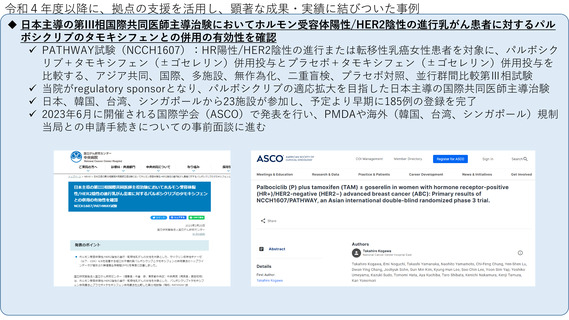
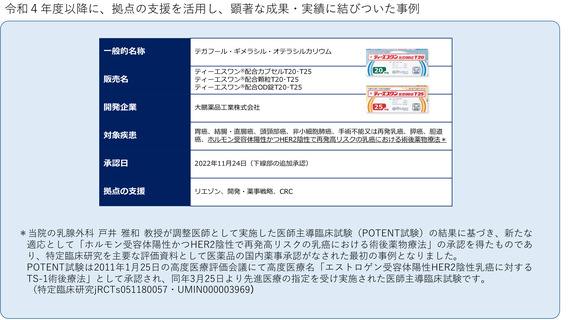
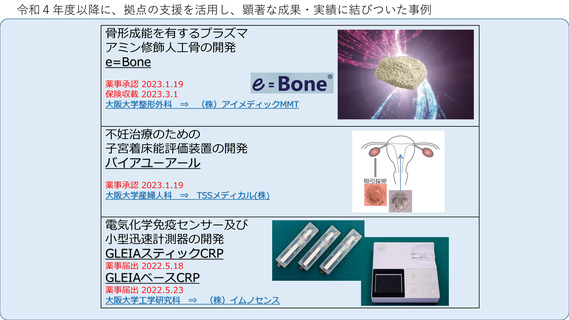
令和4年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
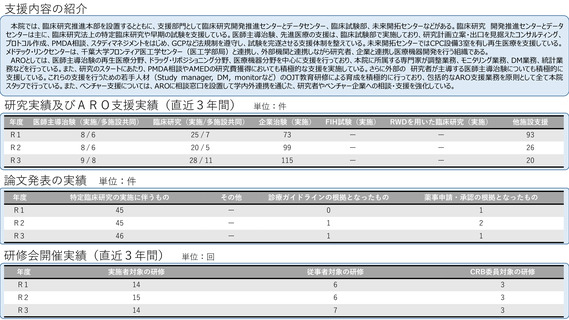
1.主な支援内容
臨床研究推進センターは、開発戦略立案(出口戦略・PMDA相談・産学連携・知財戦略など)、ガイダンス・コンサルテーション(プロトコル作
成など)、スタディマネジメント(調整事務局業務など)、生物統計(試験デザイン、症例数設計など)、データマネジメント(EDC構築など)、
モニタリング、安全性情報管理、試験薬管理、CRCなどの支援。P1ユニットにおけるPhase Ⅰ試験(FIH試験を含む)、その他の臨床薬理試験な
どの実施を支援。臨床研究ガバナンス部は、治験のQMSや監査を支援。
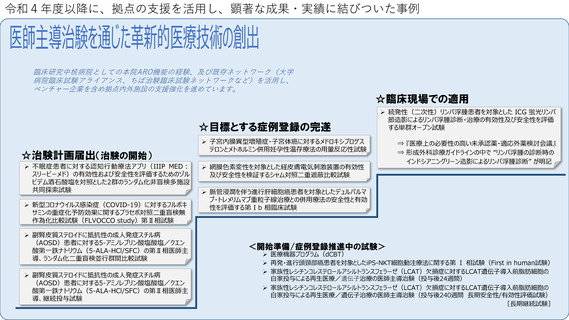
2.支援例
1)拠点の全面的支援の下に薬事承認の取得を目指している主な医師主導治験
(1)多系統萎縮症
・還元型ユビキノールについて、患者リクルートにレジストリーを活用しつつ多施設共同医師主導治験を完遂し、論文発表後、プレスリリー
ス。
・製薬企業とライセンス契約締結。
(2)難治性前庭機能障害
・携帯型電気刺激装置について、多施設共同医師主導治験(ピボタル試験)を完遂。
・ものつくり企業・製販企業と連携して臨床使用を想定した機器改良を実施済。
(3)福山型筋ジストロフィー
・核酸製剤について、多施設共同医師主導治験(Phase Ⅰ)を実施中。
・治験完遂後に連携企業に導出予定。
(4)眼内悪性リンパ腫
・既承認医薬品について、多施設共同医師主導治験を実施中。
・治験完遂後に連携企業が承認申請予定。
(5)2型糖尿病
・行動変容アプリについて、多施設共同医師主導治験を立上げ。
(6)神経膠腫
・交流電場腫瘍治療機器について、多施設共同医師主導治験を立上げ。
2)COVID-19関連
(1)治療薬候補(ナファモスタット)について、多施設共同の特定臨床研究を完遂し、論文発表。
(2)人工知能を用いたCOVID-19の重症度・予後予測トリアージシステムについて、企業に導出(承認申請済み)。
1.主な支援内容
臨床研究推進センターは、開発戦略立案(出口戦略・PMDA相談・産学連携・知財戦略など)、ガイダンス・コンサルテーション(プロトコル作
成など)、スタディマネジメント(調整事務局業務など)、生物統計(試験デザイン、症例数設計など)、データマネジメント(EDC構築など)、
モニタリング、安全性情報管理、試験薬管理、CRCなどの支援。P1ユニットにおけるPhase Ⅰ試験(FIH試験を含む)、その他の臨床薬理試験な
どの実施を支援。臨床研究ガバナンス部は、治験のQMSや監査を支援。
2.支援例
1)拠点の全面的支援の下に薬事承認の取得を目指している主な医師主導治験
(1)多系統萎縮症
・還元型ユビキノールについて、患者リクルートにレジストリーを活用しつつ多施設共同医師主導治験を完遂し、論文発表後、プレスリリー
ス。
・製薬企業とライセンス契約締結。
(2)難治性前庭機能障害
・携帯型電気刺激装置について、多施設共同医師主導治験(ピボタル試験)を完遂。
・ものつくり企業・製販企業と連携して臨床使用を想定した機器改良を実施済。
(3)福山型筋ジストロフィー
・核酸製剤について、多施設共同医師主導治験(Phase Ⅰ)を実施中。
・治験完遂後に連携企業に導出予定。
(4)眼内悪性リンパ腫
・既承認医薬品について、多施設共同医師主導治験を実施中。
・治験完遂後に連携企業が承認申請予定。
(5)2型糖尿病
・行動変容アプリについて、多施設共同医師主導治験を立上げ。
(6)神経膠腫
・交流電場腫瘍治療機器について、多施設共同医師主導治験を立上げ。
2)COVID-19関連
(1)治療薬候補(ナファモスタット)について、多施設共同の特定臨床研究を完遂し、論文発表。
(2)人工知能を用いたCOVID-19の重症度・予後予測トリアージシステムについて、企業に導出(承認申請済み)。