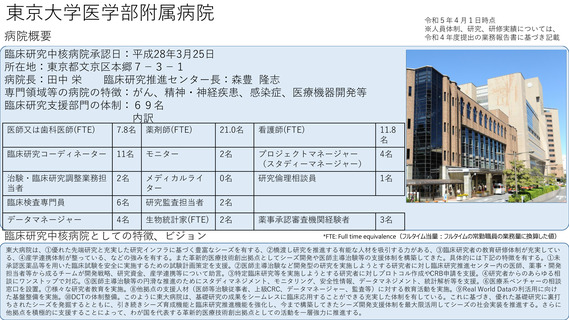
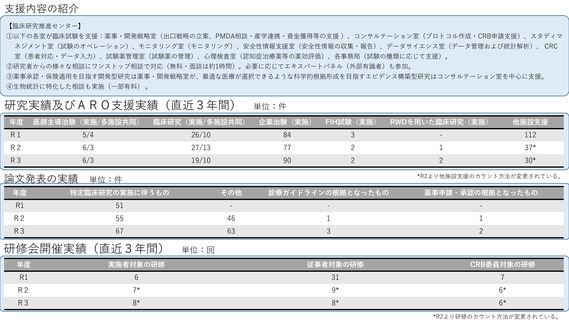
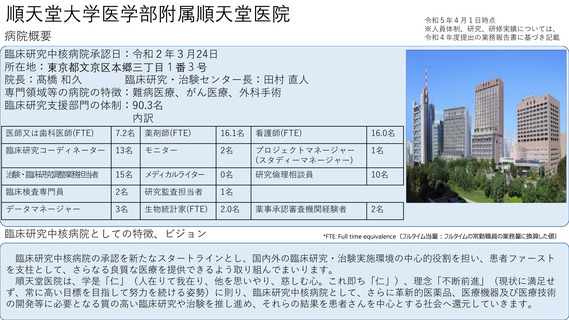
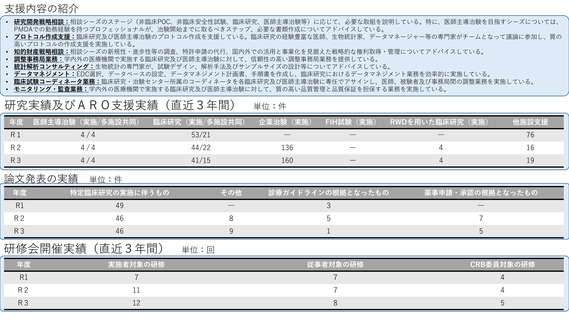
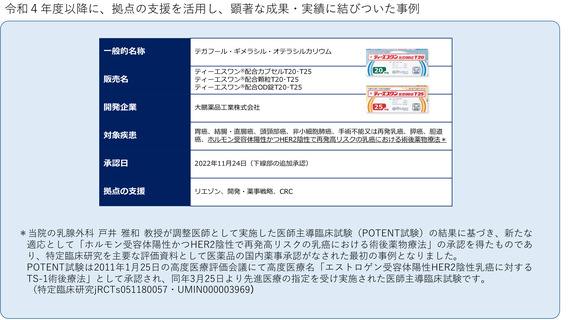
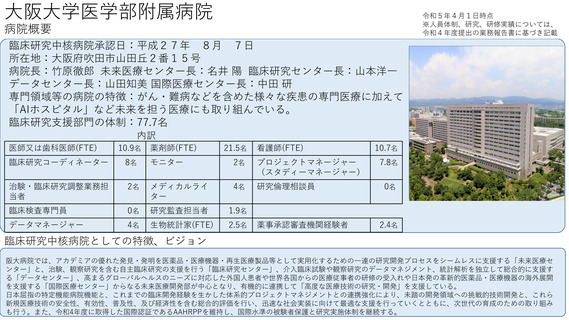
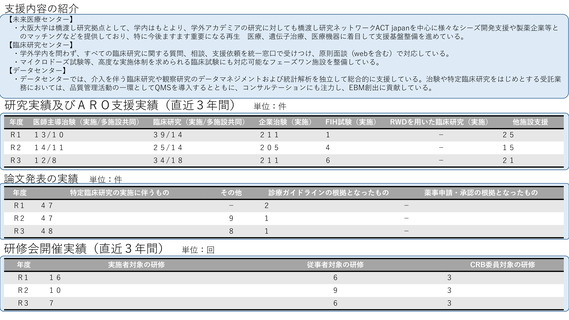
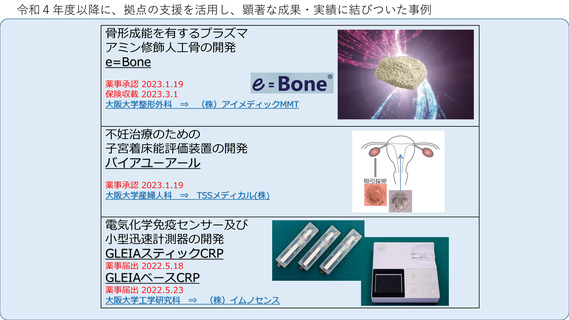
よむ、つかう、まなぶ。
参考資料1:臨床研究中核病院概要表 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
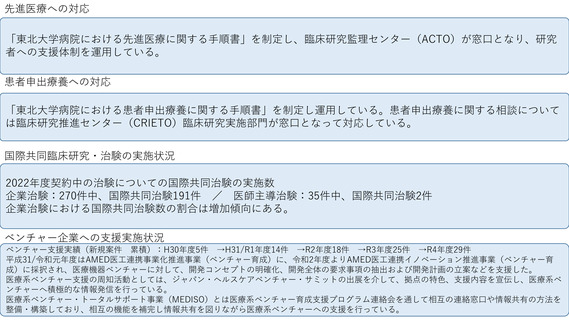
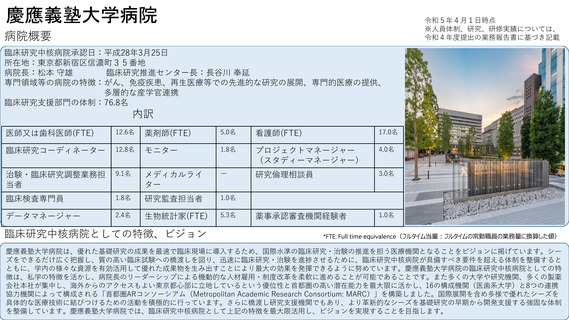
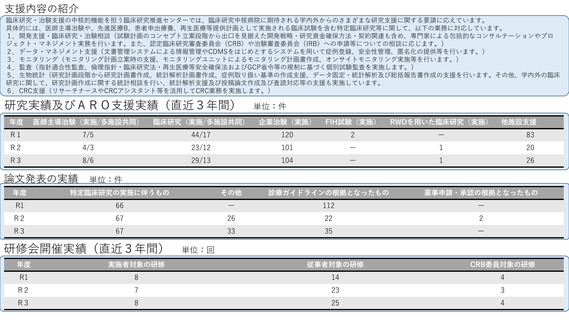
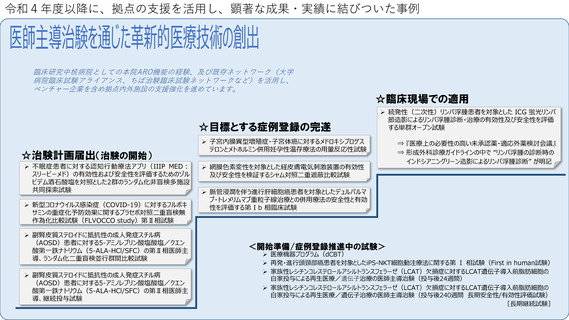
先進医療への対応
これまでに先進医療16試験の調整事務局として支援した実績があり、令和4年度は中央病院を申請医療機関とした先進医療2試験が
新たに告示された。先進医療の実施を予定する医療機関を対象として、2018年より先進医療コンサルテーションを開始している。
先進医療の実施に必要な試験計画書や申請書類の作成、実施体制等について幅広く助言をおこない、厚生労働省での事前相談や先
進医療実施に向けた申請等が迅速に実施できるよう支援を行うことを目的しており、令和4年度は2試験について対応した。
患者申出療養への対応
これまでに患者申出療養3試験の調整事務局として支援した実績があり、令和4年度は患者申出療養の実施に係る相談を4試験受けた。
そのうち1試験について患者からの申出を受け、実施の可否を審議し新たに告示された。患者への対応として、患者申出療養専用セ
カンドオピニオン外来を設け、相談を受け付けている。
国際共同臨床研究・治験の実施状況
2016年にAMED国際共同臨床研究実施推進拠点として指定され、さらに2020年度からはAMED「アジア地域における臨床研究・治験ネット
ワークの構築事業」に採択されるなど、アジアや欧州との国際共同試験を積極的に推進している。特に2020年度からはATLASプロジェクト
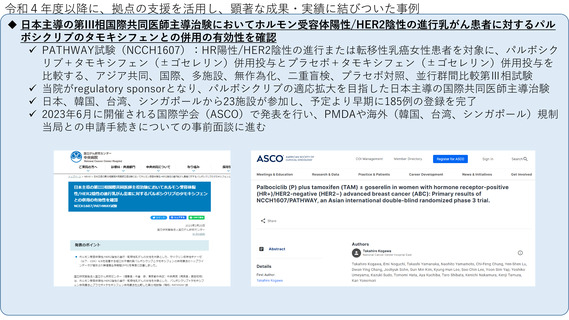
として、アジア8か国でのアジアがん臨床試験ネットワーク構築を進めている。その成果として乳がんアジア医師主導治験であるPATHWAY
試験の結果を報告し、また、希少がん開発基盤であるMASTER KEYプロジェクトをアジア展開するなど(MASTER KEY ASIA)、現在アジ
ア圏での国際共同研究を4件登録中、3件準備中である。これらの研究支援で得た国際共同試験実施のためのノウハウ(施設間調整、倫理審
査、試料・キット輸出入、薬剤搬送、規制当局対応等)については、国際共同試験コンサルテーション等の枠組みで他拠点にも情報提供を
行っている。
ベンチャー企業への支援実施状況
臨床研究支援部門の機器開発・薬事管理室を窓口として、PMDAでの承認審査経験者によるベンチャー相談を平成29年8月より開始している。
令和4年度は、医療技術実用化総合促進事業医療系ベンチャー育成支援プログラム連絡会および、令和4年10月のジャパンヘルスケアベン
チャーサミット(JHVS)に出展を行い、当院の臨床研究支援機能やベンチャー相談機能について対外的な発信を行った。マッチングシステ
ムを通じて5件のオファーがあったものの、いずれも当院のニーズと合致せず面談は0件であった。医療系ベンチャー相談についても令和4年
度は申請がなく0件であった。今年度の相談実績はなかったものの、令和3年度に実施した外部アカデミア機関からの医療系ベンチャー相談
案件1件が、PMDA相談を経て当院の臨床研究支援部門の支援を受け医師主導治験を実施することとなった。
これまでに先進医療16試験の調整事務局として支援した実績があり、令和4年度は中央病院を申請医療機関とした先進医療2試験が
新たに告示された。先進医療の実施を予定する医療機関を対象として、2018年より先進医療コンサルテーションを開始している。
先進医療の実施に必要な試験計画書や申請書類の作成、実施体制等について幅広く助言をおこない、厚生労働省での事前相談や先
進医療実施に向けた申請等が迅速に実施できるよう支援を行うことを目的しており、令和4年度は2試験について対応した。
患者申出療養への対応
これまでに患者申出療養3試験の調整事務局として支援した実績があり、令和4年度は患者申出療養の実施に係る相談を4試験受けた。
そのうち1試験について患者からの申出を受け、実施の可否を審議し新たに告示された。患者への対応として、患者申出療養専用セ
カンドオピニオン外来を設け、相談を受け付けている。
国際共同臨床研究・治験の実施状況
2016年にAMED国際共同臨床研究実施推進拠点として指定され、さらに2020年度からはAMED「アジア地域における臨床研究・治験ネット
ワークの構築事業」に採択されるなど、アジアや欧州との国際共同試験を積極的に推進している。特に2020年度からはATLASプロジェクト
として、アジア8か国でのアジアがん臨床試験ネットワーク構築を進めている。その成果として乳がんアジア医師主導治験であるPATHWAY
試験の結果を報告し、また、希少がん開発基盤であるMASTER KEYプロジェクトをアジア展開するなど(MASTER KEY ASIA)、現在アジ
ア圏での国際共同研究を4件登録中、3件準備中である。これらの研究支援で得た国際共同試験実施のためのノウハウ(施設間調整、倫理審
査、試料・キット輸出入、薬剤搬送、規制当局対応等)については、国際共同試験コンサルテーション等の枠組みで他拠点にも情報提供を
行っている。
ベンチャー企業への支援実施状況
臨床研究支援部門の機器開発・薬事管理室を窓口として、PMDAでの承認審査経験者によるベンチャー相談を平成29年8月より開始している。
令和4年度は、医療技術実用化総合促進事業医療系ベンチャー育成支援プログラム連絡会および、令和4年10月のジャパンヘルスケアベン
チャーサミット(JHVS)に出展を行い、当院の臨床研究支援機能やベンチャー相談機能について対外的な発信を行った。マッチングシステ
ムを通じて5件のオファーがあったものの、いずれも当院のニーズと合致せず面談は0件であった。医療系ベンチャー相談についても令和4年
度は申請がなく0件であった。今年度の相談実績はなかったものの、令和3年度に実施した外部アカデミア機関からの医療系ベンチャー相談
案件1件が、PMDA相談を経て当院の臨床研究支援部門の支援を受け医師主導治験を実施することとなった。