よむ、つかう、まなぶ。
資料6_AMEDがん研究(2019年度-2022年度) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32589.html |
| 出典情報 | 今後のがん研究のあり方に関する有識者会議(第10回 4/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
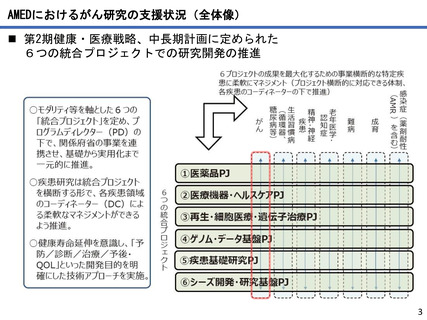
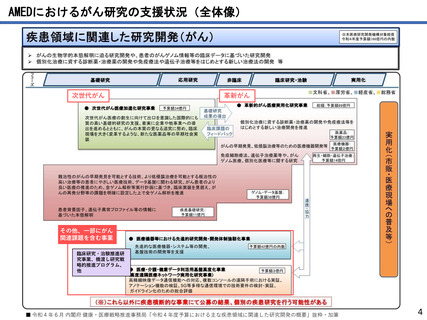
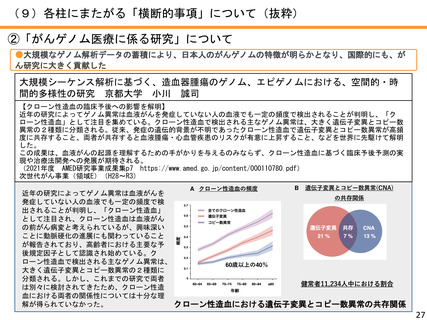
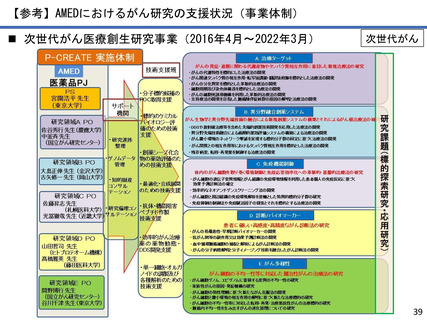
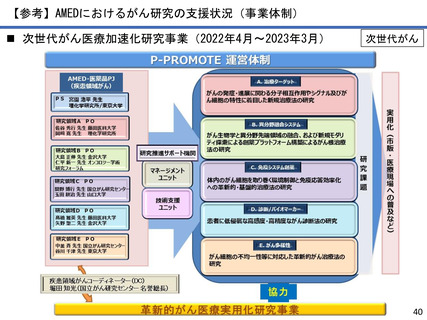
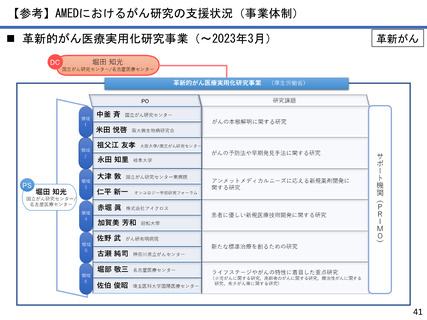
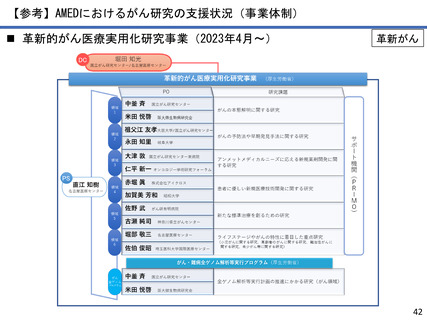
AMEDにおけるがん研究の成果例
●薬事承認例
難治性神経芽腫に対するIL2、CSF 併用ch14.18 免疫療法の国内臨床開発
大阪市立総合医療センター 原 純一
2010年に米国小児がんグループから、神経芽腫に対するがん免疫療法として抗GD2抗体を用いることで、約20%生存率が向
上することが発表され、北米や欧州においては、本治療法が神経芽腫の標準治療として用いられている。
わが国では神経芽腫は希少疾患であるため、製薬会社主導による抗GD2抗体の国内導入の見通しがつかないことから、医
師主導治験にて承認を目指すこととし、米国で免疫強化のために併用された薬剤(サルグラモスチム、アルデスロイキ
ン)が今後も入手不可能であることより、代替としてフィルグラスチム(G-CSF製剤)とテセロイキン(IL-2製剤)を用
いた。平成25年から開始した第I相及び第II相試験の結果、本治療法が米国で用いられた治療法と遜色のない有効性を示
したことから、ジヌツキシマブは、厚生労働省より希少疾病用医薬品に指定され、大原薬品工業株式会社より薬事承認申
請が行われ、同時に、併用薬であるフィルグラスチム、テセロイキンの適応拡大の承認申請が行われた。この結果、令和
3年6月23日に薬事承認された。
代表的な小児がんである神経芽腫に対してジヌツキシマブが承認―小児がん用抗がん剤で初めての医師主導治験による国
内承認取得―(令和3年6月24日AMED共同プレスリリース)
https://www.amed.go.jp/news/release_20210624-03.html 革新がん事業(領域3)(R1~R3)
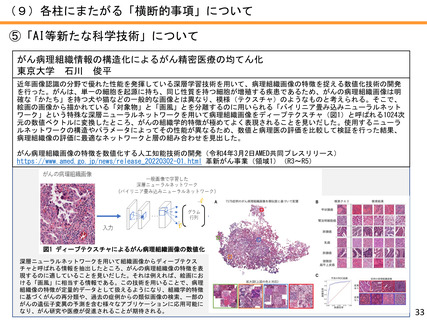
●研究成果を活用した臨床試験・治験への移行例
先天性巨大色素性母斑を母地とした悪性黒色腫に対する予防的低侵襲治療方法の開発〜高圧
処理新規医療機器の研究開発
京都大学 森本 尚樹
先天性巨大色素性母斑に対して、切除母斑組織を高圧処理により不活化させ、自家真皮再生に再利用できることを明らか
にした。本治療に用いる高圧処置装置の医療機器承認を目指した医師主導治験を行い、終了している。
承認申請を見据え、PMDAと協議中であり、日本発の新規医療機器と新規治療法の高圧処理・組織再移植治療を世界へ発信
することを目指す。
色素性母斑に対する皮膚再生臨床試験が終了―高圧殺細胞装置の医師主導治験へ―(令和3年7月1日AMED共同プレスリリー
ス)
https://www.amed.go.jp/news/release_20210701.html 革新がん事業(領域4)(R2~R4)
7
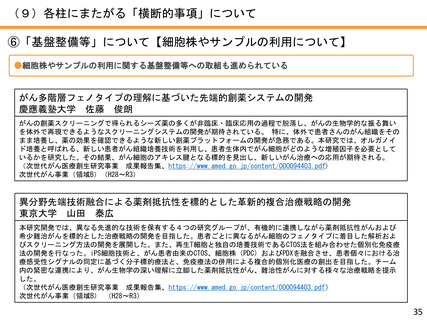
●薬事承認例
難治性神経芽腫に対するIL2、CSF 併用ch14.18 免疫療法の国内臨床開発
大阪市立総合医療センター 原 純一
2010年に米国小児がんグループから、神経芽腫に対するがん免疫療法として抗GD2抗体を用いることで、約20%生存率が向
上することが発表され、北米や欧州においては、本治療法が神経芽腫の標準治療として用いられている。
わが国では神経芽腫は希少疾患であるため、製薬会社主導による抗GD2抗体の国内導入の見通しがつかないことから、医
師主導治験にて承認を目指すこととし、米国で免疫強化のために併用された薬剤(サルグラモスチム、アルデスロイキ
ン)が今後も入手不可能であることより、代替としてフィルグラスチム(G-CSF製剤)とテセロイキン(IL-2製剤)を用
いた。平成25年から開始した第I相及び第II相試験の結果、本治療法が米国で用いられた治療法と遜色のない有効性を示
したことから、ジヌツキシマブは、厚生労働省より希少疾病用医薬品に指定され、大原薬品工業株式会社より薬事承認申
請が行われ、同時に、併用薬であるフィルグラスチム、テセロイキンの適応拡大の承認申請が行われた。この結果、令和
3年6月23日に薬事承認された。
代表的な小児がんである神経芽腫に対してジヌツキシマブが承認―小児がん用抗がん剤で初めての医師主導治験による国
内承認取得―(令和3年6月24日AMED共同プレスリリース)
https://www.amed.go.jp/news/release_20210624-03.html 革新がん事業(領域3)(R1~R3)
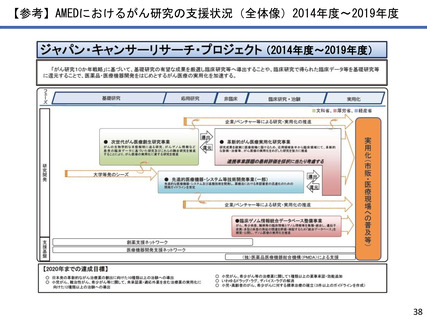
●研究成果を活用した臨床試験・治験への移行例
先天性巨大色素性母斑を母地とした悪性黒色腫に対する予防的低侵襲治療方法の開発〜高圧
処理新規医療機器の研究開発
京都大学 森本 尚樹
先天性巨大色素性母斑に対して、切除母斑組織を高圧処理により不活化させ、自家真皮再生に再利用できることを明らか
にした。本治療に用いる高圧処置装置の医療機器承認を目指した医師主導治験を行い、終了している。
承認申請を見据え、PMDAと協議中であり、日本発の新規医療機器と新規治療法の高圧処理・組織再移植治療を世界へ発信
することを目指す。
色素性母斑に対する皮膚再生臨床試験が終了―高圧殺細胞装置の医師主導治験へ―(令和3年7月1日AMED共同プレスリリー
ス)
https://www.amed.go.jp/news/release_20210701.html 革新がん事業(領域4)(R2~R4)
7