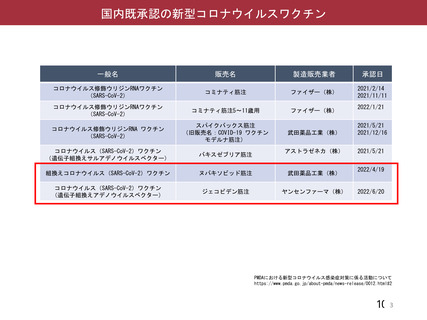
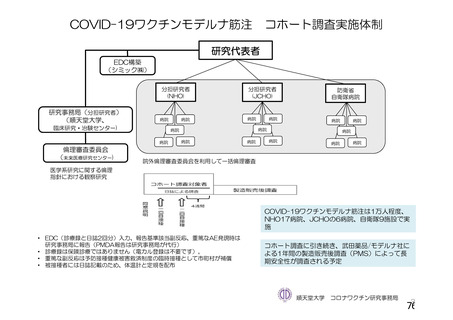
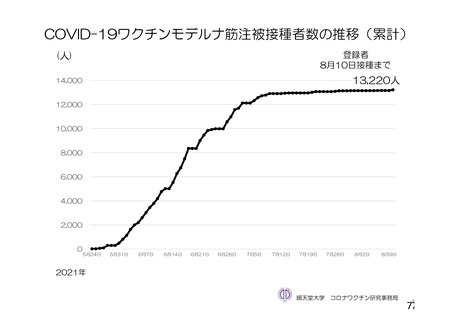
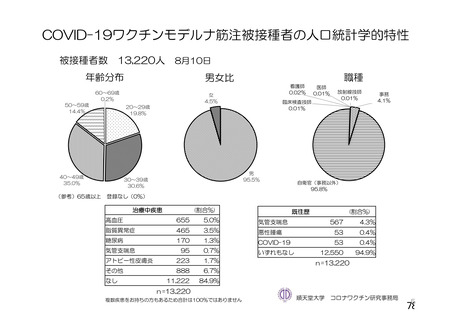
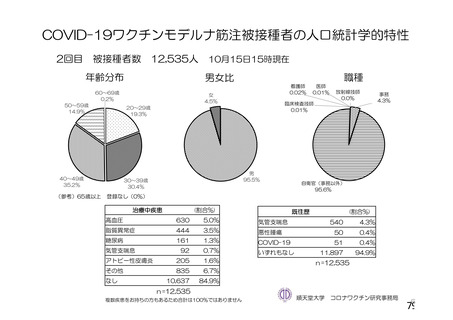
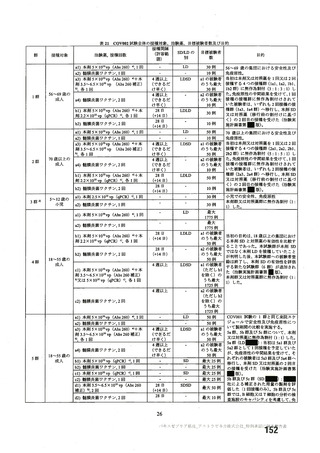
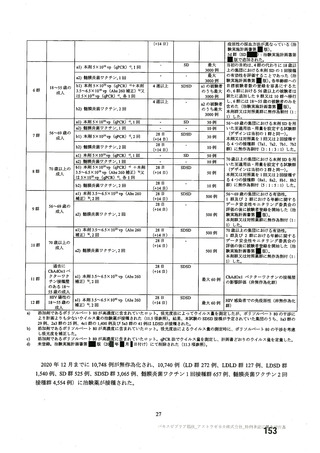
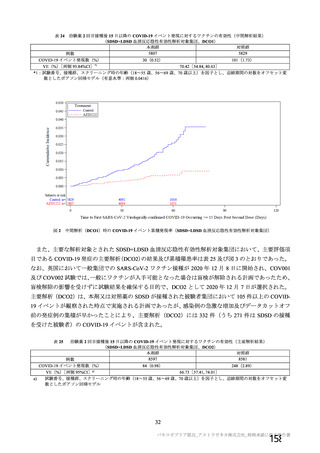
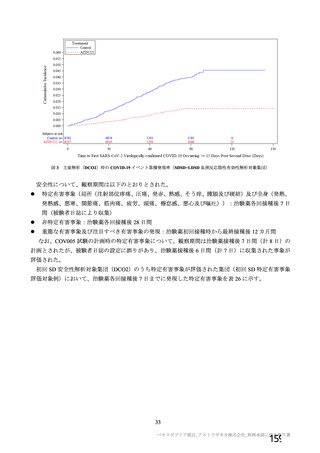
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (205 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
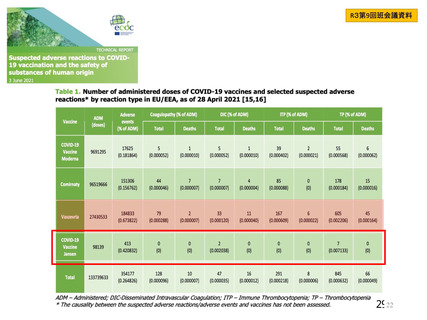
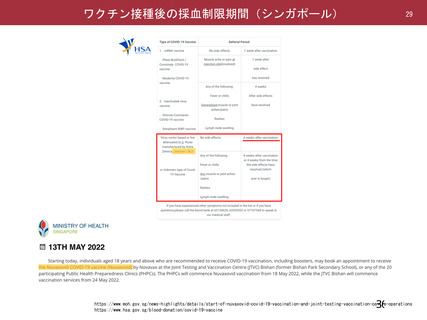
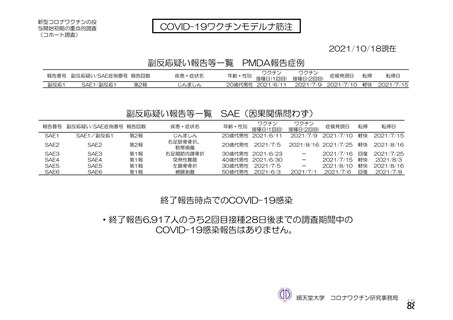
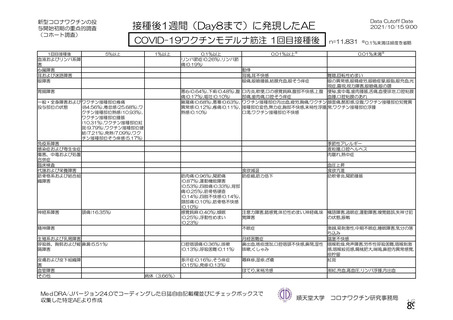
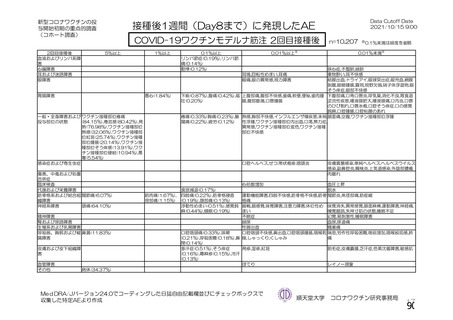
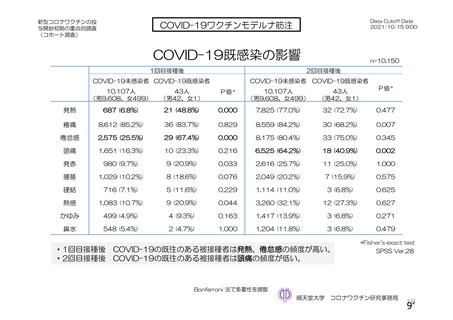
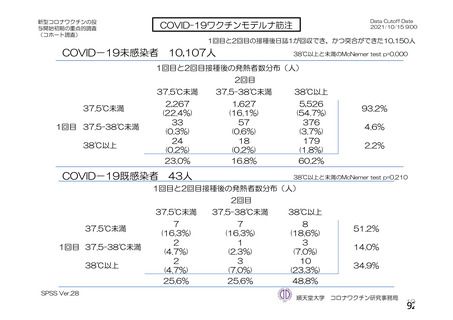
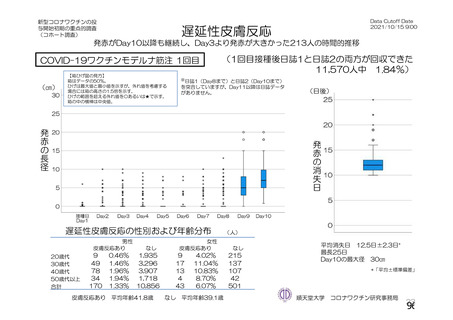
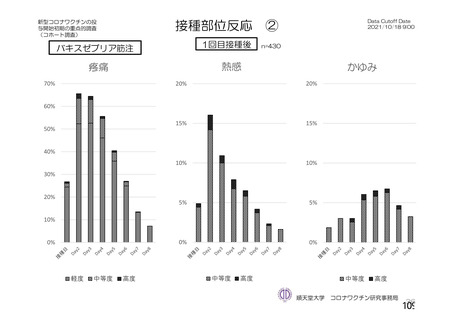
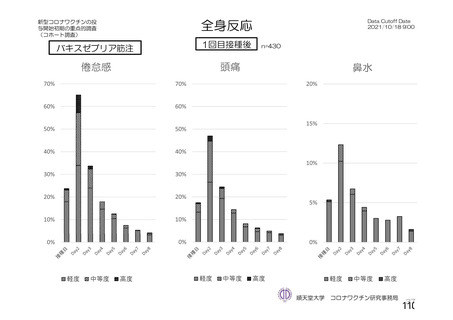
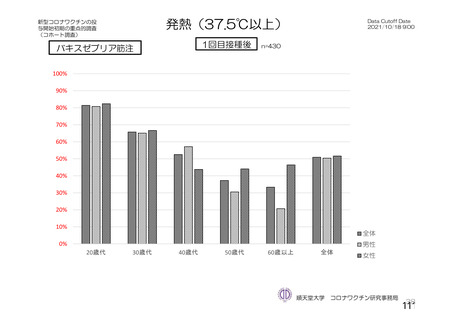
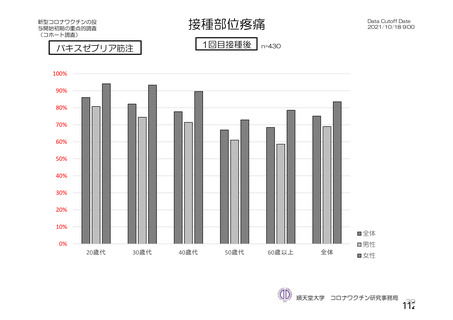
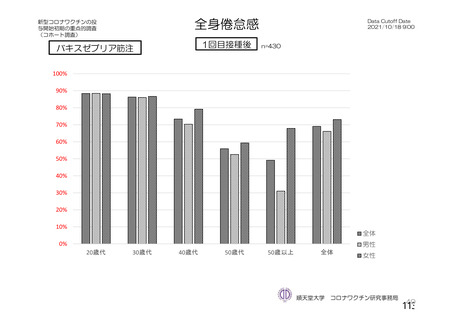
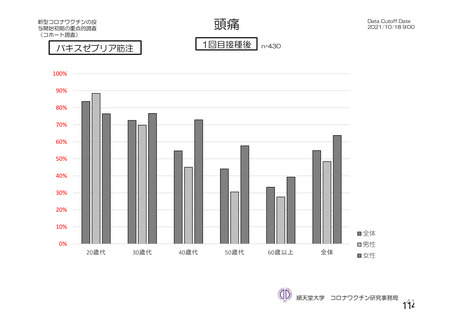
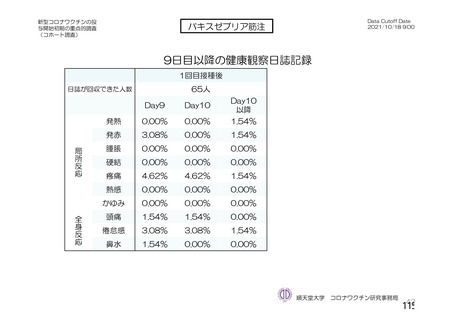
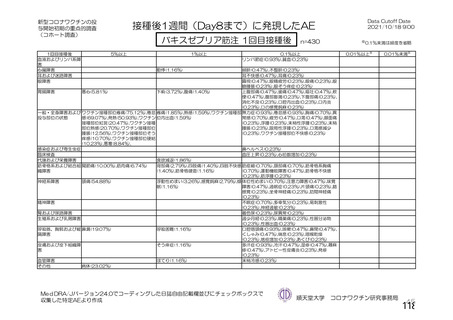
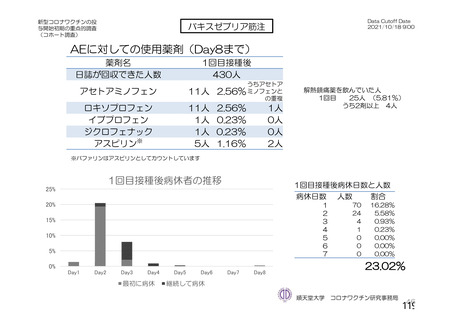
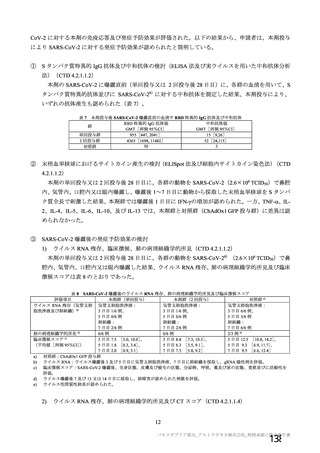
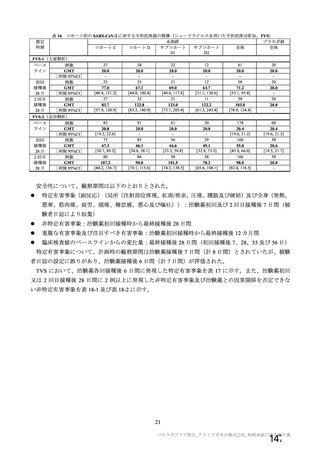
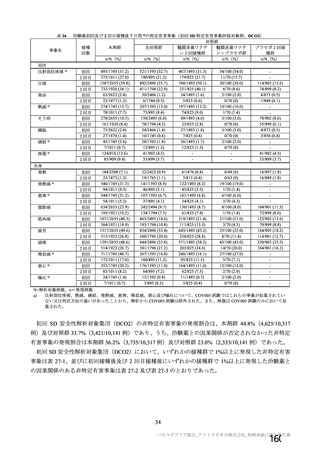
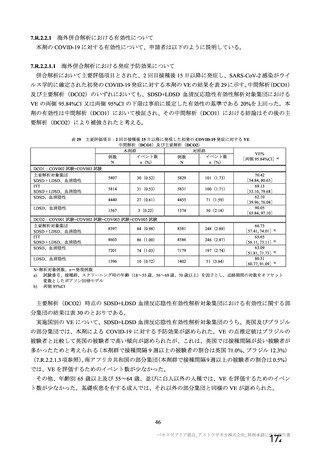
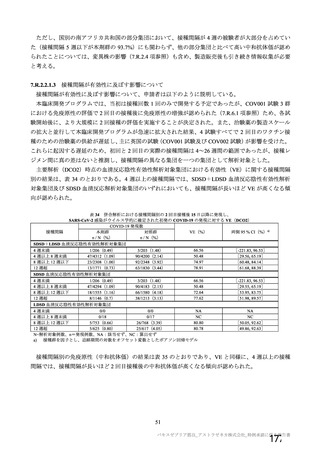
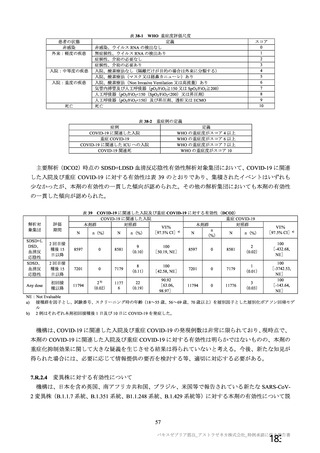
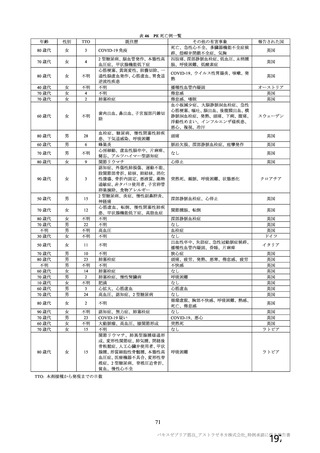
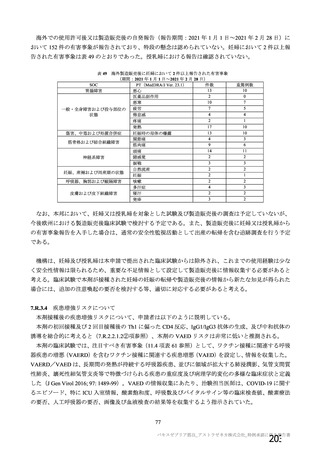
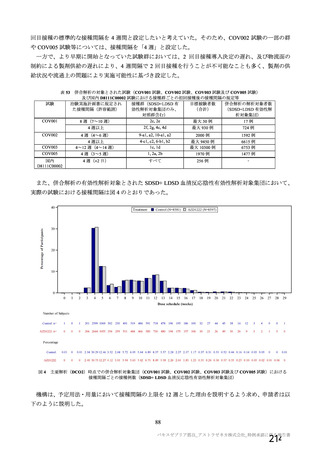
海外製造販売後に 65 歳以上の高齢者で 50 件以上報告された副反応(PT)
(期間:2021 年 1 月 1 日~2021 年 2 月 28 日)
SOC
PT(MedDRA/J Ver.23.1)
件数
重篤例数
73
61
心臓障害
動悸
82
70
腹痛
77
63
上腹部痛
256
204
胃腸障害
下痢
785
714
悪心
378
322
嘔吐
126
115
無力症
52
45
胸痛
1067
935
悪寒
132
131
死亡
965
838
疲労
一般・全身障害および投与部位
167
147
冷感
の状態
103
97
疾患
232
197
インフルエンザ様疾患
404
348
倦怠感
169
144
疼痛
1200
1014
発熱
190
167
感染症および寄生虫症
インフルエンザ
55
47
傷害、中毒および処置合併症
注射に伴う反応
161
149
代謝および栄養障害
食欲減退
413
372
関節痛
74
64
背部痛
筋骨格系および結合組織障害
423
379
筋肉痛
236
180
四肢痛
341
298
浮動性めまい
1691
1465
頭痛
112
95
嗜眠
神経系障害
62
53
錯感覚
71
62
失神
403
361
振戦
79
67
精神障害
錯乱状態
54
46
咳嗽
100
80
呼吸器、胸郭および縦隔障害
呼吸困難
51
41
口腔咽頭痛
153
134
多汗症
66
47
皮膚および皮下組織障害
そう痒症
82
40
発疹
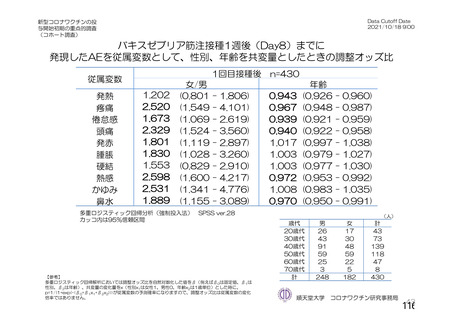
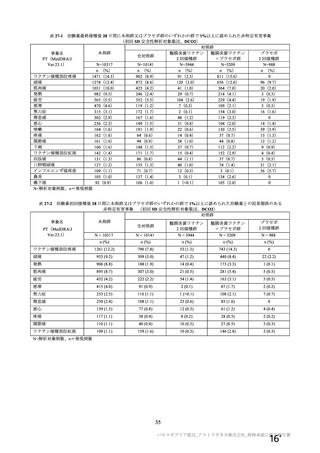
機構は、臨床試験における安全性の結果から、65 歳以上の高齢者では局所及び全身の特定有害事象の
重症度及び発現割合、非特定有害事象の発現割合は、18~64 歳と比較して低く、発現した有害事象は類
似していることから、18~64 歳と比較して 65 歳以上においてさらなる注意喚起を要する事項はないと
判断した。
7.R.3.3.3
妊婦における安全性について
妊婦に対する安全性について、申請者は以下のように説明している。
併合解析に含まれた海外 4 試験では、妊娠中、授乳中又は妊娠を希望する女性は除外し、妊娠可能な
女性は有効性の高い避妊法を継続して使用することを必須とした。併合解析の主要解析(DCO2)時点で
は、妊娠が 40 例(本剤群 24 例、対照群 16 例)に認められた。妊娠中絶は本剤群 4 例及び対照群 3 例、
自然流産は本剤群 4 例及び対照群 3 例に認められた。妊娠中の女性での本剤接種、本剤接種後に妊娠し
た女性及び授乳中の女性における本剤接種のデータは限られているが、すべての妊娠について、転帰が
確認されるまで追跡調査を実施する予定である。なお、本剤の生殖発生毒性試験において特段の懸念は
認められていない(5.5 項参照)。
76
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
202