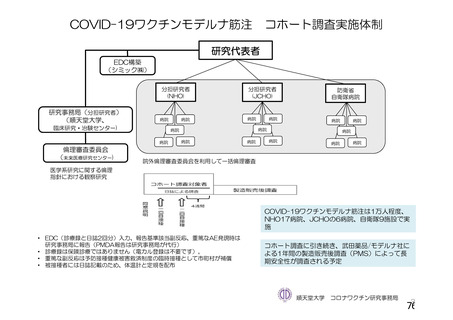
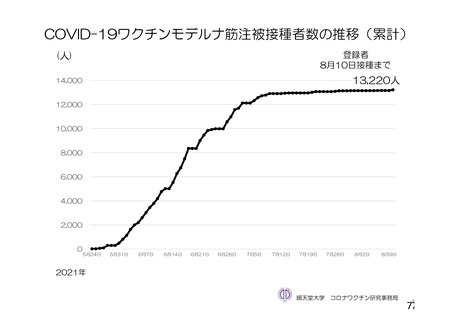
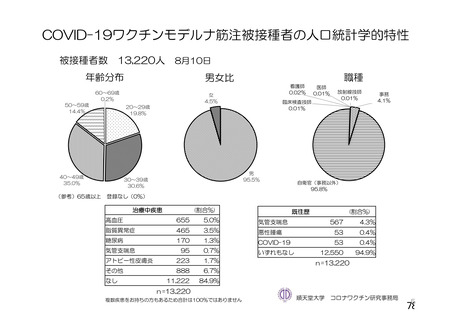
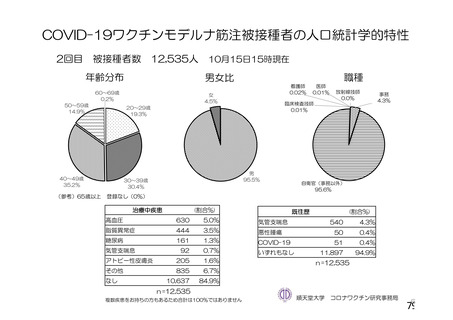
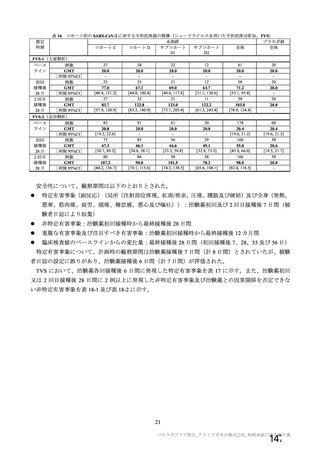
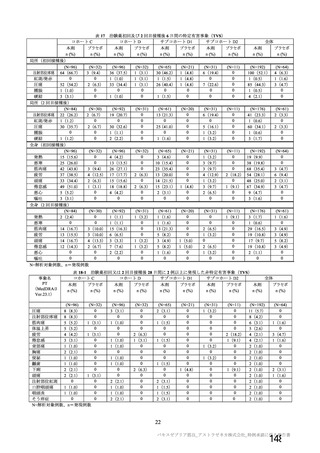
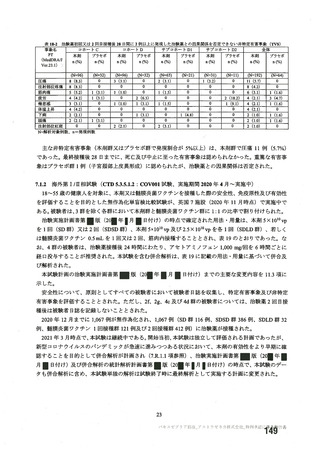
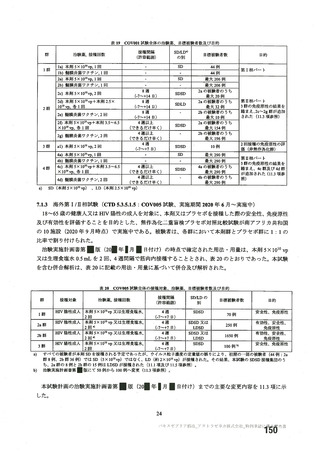
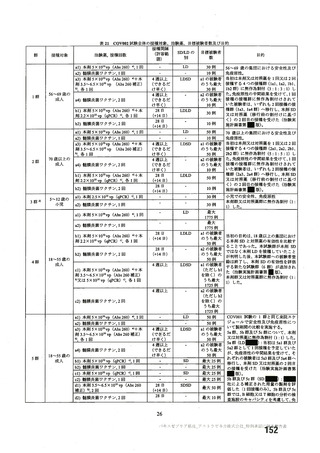
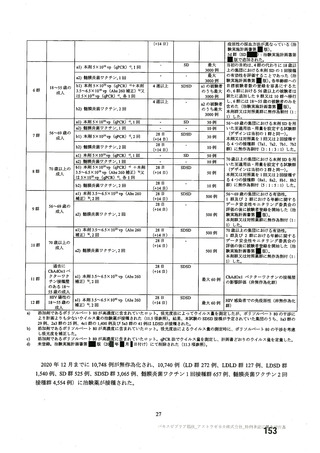
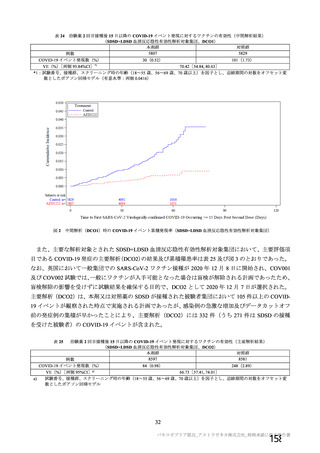
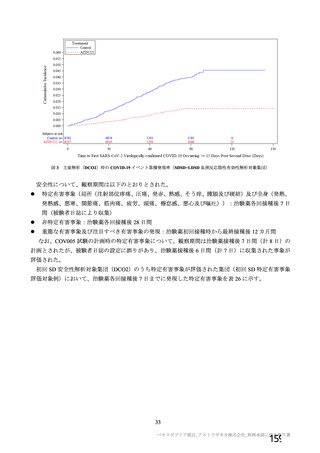
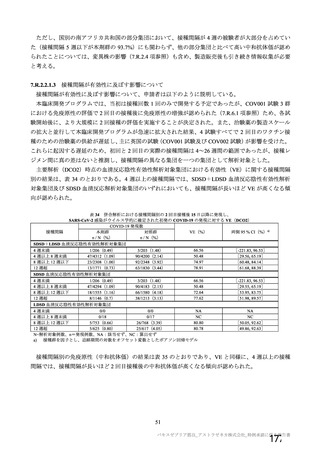
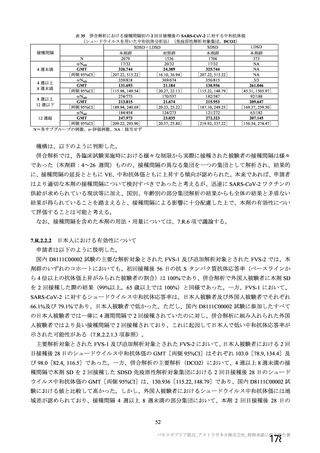
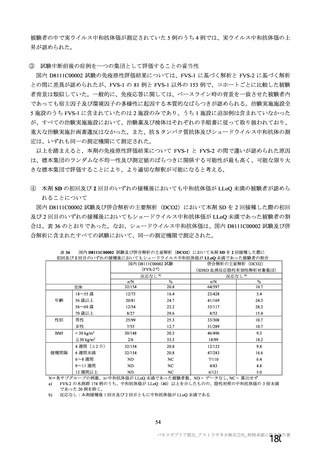
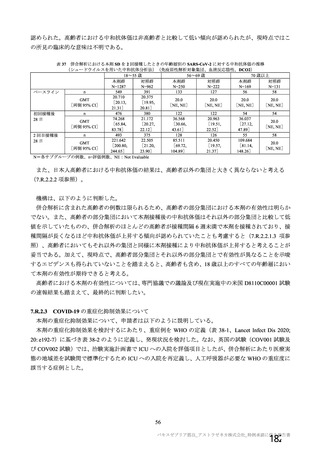
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (172 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
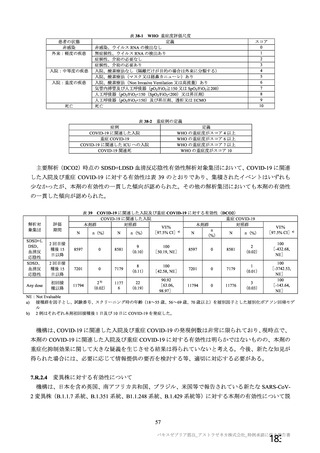
SARS-CoV-2 ワクチン候補を評価するための臨床試験の要件については、EMA 及び FDA が共同議長
を務めた ICMRA のワークショップで各国の規制当局により 2020 年 6 月に合意に至っており、主要評価
項目を「重症度を問わず、検査で確定された COVID-19」とすることが推奨されている(http://www.icm
ra.info/drupal/covid-19/vaccines_confidence_statement_for_hcps(最終確認日:2021 年 4 月 6 日))。その
後、WHO 及び EMA からも同様の勧告がなされた20)。したがって、オックスフォード大学による臨床試
験の主要な有効性評価項目は、重症度を問わない、SARS-CoV-2 感染がウイルス学的に確定された症候
性 COVID-19 とされた。
なお、無症候性 SARS-CoV-2 感染は疾患が発症している状態ではなく、主要評価項目には含まれてい
ない。また、重症 COVID-19 症例のみについて有効性評価を実施する場合、十分な検出力を得るために
非常に大規模な試験が必要となり、実施が困難である。公衆衛生上、軽度や中等度の疾患も予防するこ
とは重要であるため、重症度を問わない症候性 COVID-19 を主要評価項目としたことは適切と考える。
② 評価対象期間について
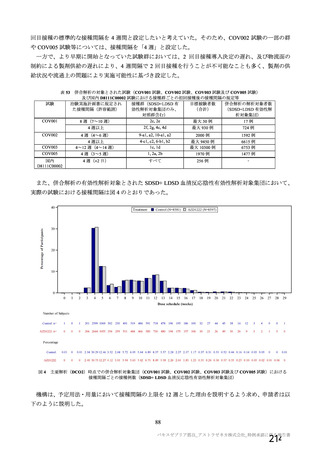
有効性の主要評価項目の評価対象期間について、免疫反応が得られる時間を考慮し、ワクチンの生物
学的作用が十分に発現され、ワクチン接種のベネフィットが十分に評価できる期間として 2 回目接種後
15 日以降と設定した。この期間の設定は臨床データに基づくものではないが、WHO ガイダンスの「主
要評価項目の解析対象には、初回接種から 14 日以上経過したのちに発現した被験者ごとの最初の
COVID-19 イベントが含まれるべき」との記載内容21)を踏まえても、適切であると考える。
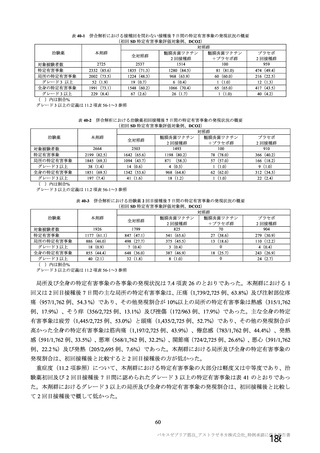
③ 主要評価項目とされた COVID-19 イベントの定義について
COVID-19 イベントの定義は、「SARS-CoV-2 感染がウイルス学的に確定され、37.8℃以上の発熱、咳
嗽、息切れ、無嗅覚又は味覚消失の少なくとも 1 つの症状を有し、エンドポイント判定委員会により確
認された症例」とした。なお、核酸増幅検査が陽性となった検体の採取日及び COVID-19 症状の発現日
がいずれも治験薬 2 回目の接種後 15 日以降であった症例のみ、イベントとして集計した。この主要評価
項目における COVID-19 の臨床症状は、COVID-19 の世界的流行の初期に、英国公衆衛生庁及び WHO の
ガイドライン22) 並びに専門家による分析に基づいて設定されたものである。この症例の定義は、適切な
COVID-19 症例の特定と確認、臨床試験の検出力及び臨床的有用性を担保するのに必要な感度と特異度
を有しており、本剤について感染症予防ワクチンとして期待される予防効果及び公衆衛生的な必要性に
基づいて予防するべき事象を反映していると考える。また、これらの臨床症状(37.8℃以上の発熱、咳
嗽、息切れ、無嗅覚又は味覚消失)は、臨床的に COVID-19 が疑われる症例を特定するために頻用され
ている。
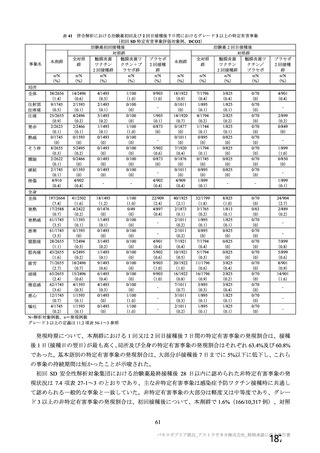
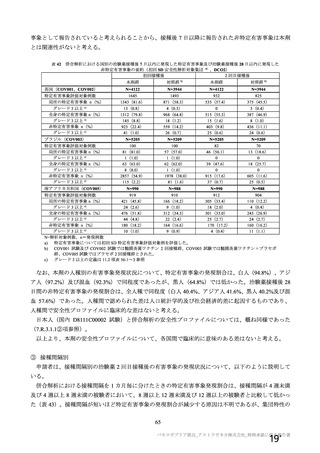
④ SARS-CoV-2 感染のウイルス学的な診断に複数の核酸増幅検査を用いたことについて
COV003 試験及び COV005 試験では SARS-CoV-2 感染のウイルス学的な診断は RT-PCR のみによった
が、オックスフォード大学が COV001 試験及び COV002 試験を開始した時には、検査試薬の供給が十分
20) Considerations for the Assessment of COVID-19 Vaccines – Points to consider for manufacturers of COVID-19 vaccines. WHO; 2020 及び EMA
considerations on COIVD-19 vaccine approval. EMA; 2020
21) WHO R&D Blueprint: novel Coronavirus. An international randomized trial of candidate vaccines against COVID-19. WHO; 2020
22 ) https://www.gov.uk/government/publications/covid-19-stay-at-home-guidance/stay-at-home-guidance-for-households-with-possible-coronaviruscovid-19-infection#symptoms (最終確認日:2021 年 4 月 6 日)及び https://www.who.int/health-topics/coronavirus#tab=tab_3 (最終確認
日:2021 年 4 月 6 日)
43
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
169