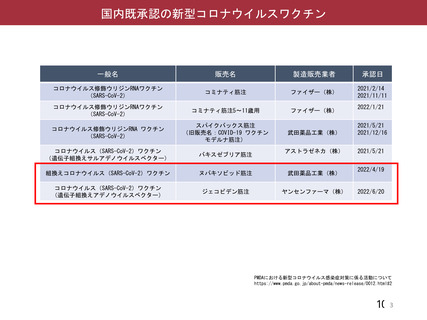
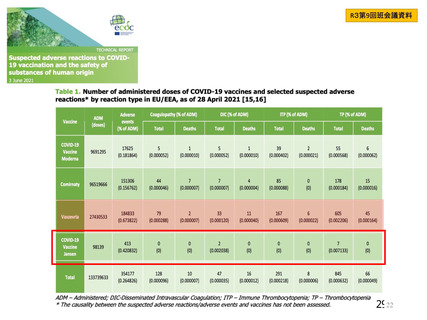
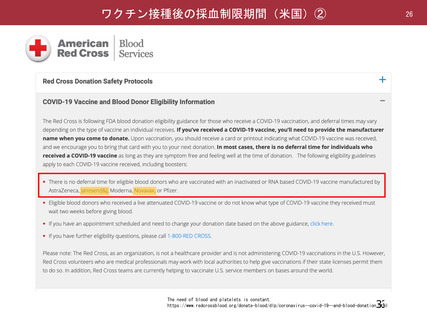
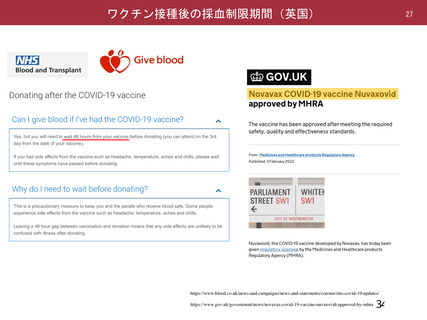
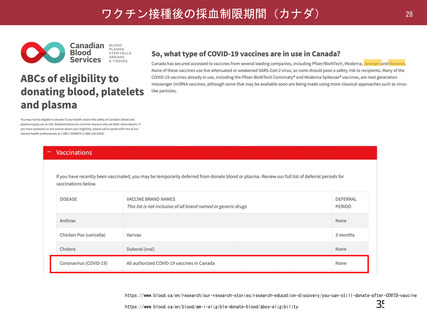
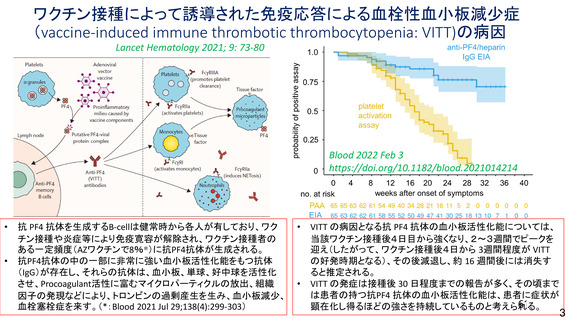
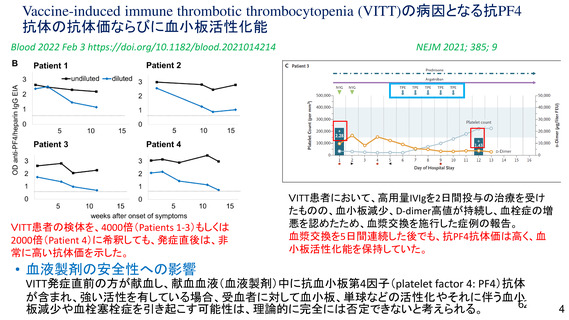
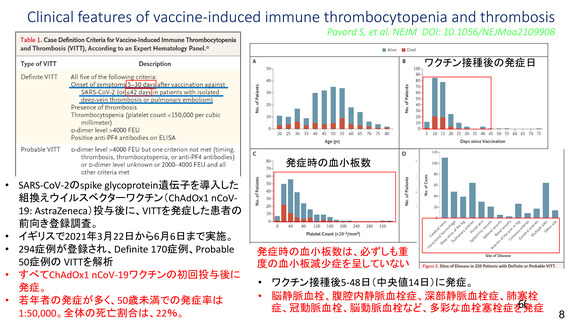
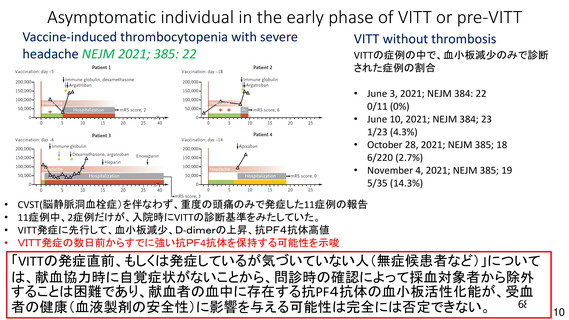
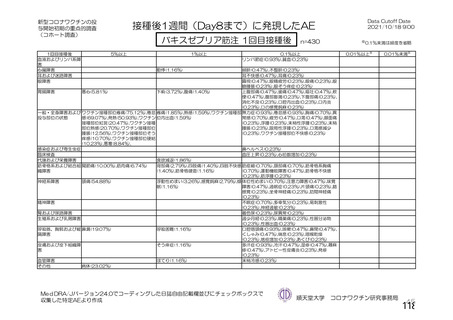
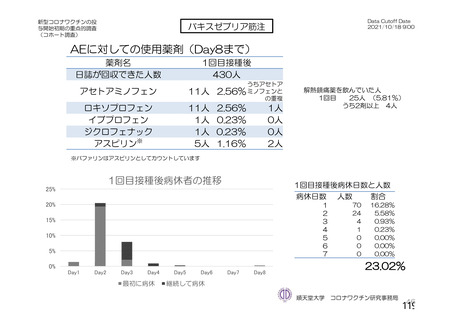
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (137 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
製剤の開発過程における製造方法の主な変更点は、表$ぅ のとおりである。了臨床試験では、製法 A、製
法 B 及び製法Cにより製造された製剤が使用されており、それぞれ製法 a、製法b 及び製法 c の原薬が
使用されている。市販予定製剤は製法 Dにより製造され、製法d の原薬が使用されている。各製法変更
にあたり、製法変更前後での製剤の品質について、ロット分析及び特性解析の試験成績より同等性同
質性が確認されている。
なお、製法b の原薬におけるポリソルベート 80 の過量添加により、一部の製法 B の製剤でウイルス
粒子濃度の定量値の誤りが生じたこと 11.5 項参照) について、審査の項で議論する (2.R.2 項参照) 。
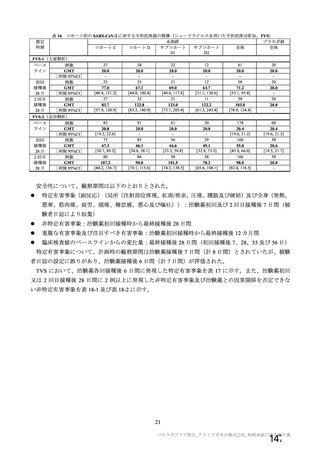
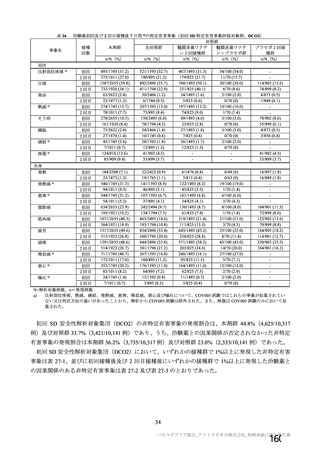
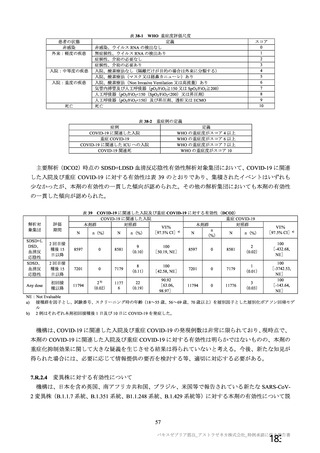
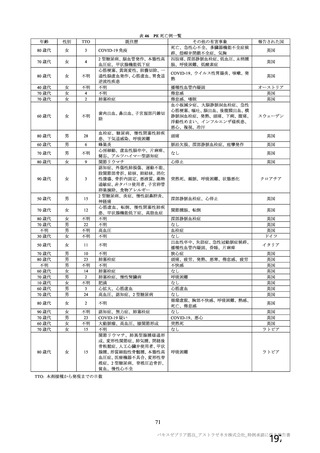
表3 製剤の製造方法の主な変更点
製法 変更点
| | ESS22 3
村ADか ・還還還の誠区
んから近F | ・還還還還の交豆
の交 (
変更及び還還の変更
kpから製法 で) | 上還還還な
製法B から製法C9 ・還証請主の変更 (還還語詞
人(
ECなら 本 _ 辱紅
、、-'。 | 還っ天 (還昌
1 還っ 較還 ti、) 還証思 i、 。 還還還還国生
2.2.4 製剤の管理
製剤の規格及び試験方法として、 性状、 確認試験 (qaPCR) 、 浸透圧、 pH 試験、DNA : タンパク質比、
ウイルス粒子 : 感染性ウイルス粒子比、不溶性異物、不溶性微粒子、採取容量、ニエンドトキシン、和無菌
試験、 生物学的活性 (感染価) 、 ポリソルベート 80 及び定量法 (ウイルス粒子濃度) が設定されている。
2.2.5 製剤の安定性
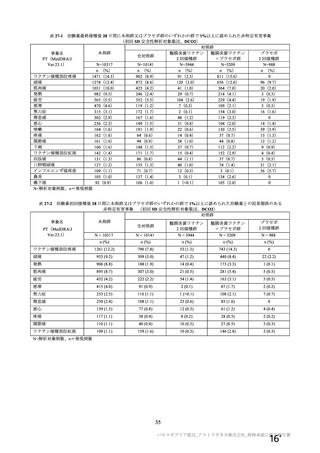
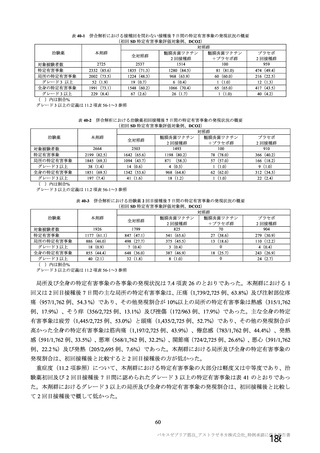
製剤の主な安定性試験の概略は、表6 のとおりである。
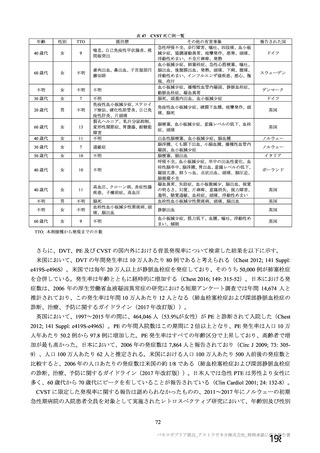
表6 製剤の安定性試験 (2021 年 3 月時点)
保存条件 原薬の製法 製剤の製法 ロット数 試験期間 保存形態
製法c9 製法C9 3 6 カ月
長期保存試験り | 3エ3C、倒立 ー
製法 製法 D9 3 0 カ月 ガラス製バイアル、
加速試験 25土2で/60圭 製法c 製法C 3 2 カカ月 プロモプチルゴム栓
3%%RH、倒立 製法 製法D 3 2 カ月
}) 長期保存試験は 12 カ月まで継続中
2) 証国 和応率、:) 還還還還還較 和※、。 還議還 i、 5) 還請請請議 拓
長期保存試験では、製法Cの製剤において、生物活性 (感染価) にわずかな減少傾向が認められたも
のの規格に適合しており、その他の品質特性も実施期間を通して明確な変化は認められず、規格に適合
した。 現時点において製法 D の長期保存試験成績は得られていないが、継続中の試験成績については報
告 2②) に記載する (有効期間については 2.R.1 項参照) 。
*キスセブリア物注 アストラセキモカ株式会社 特例 明生 1 告書