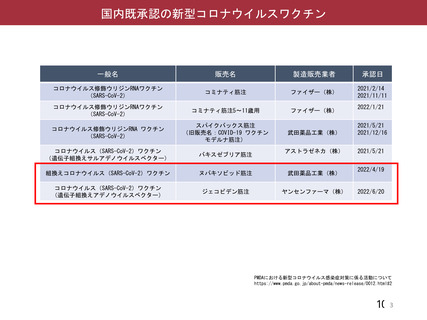
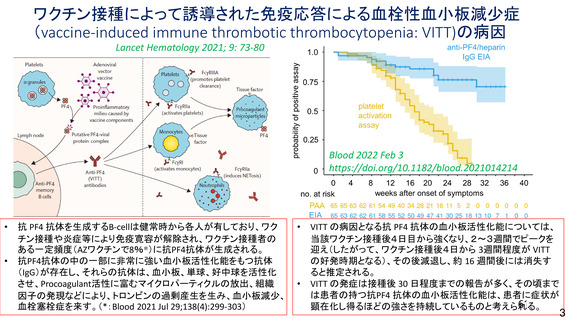
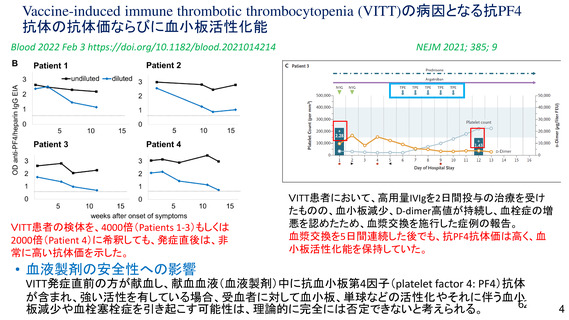
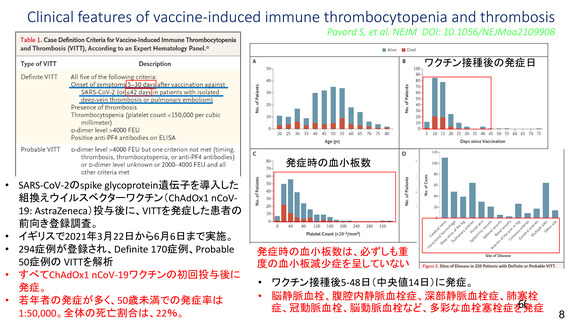
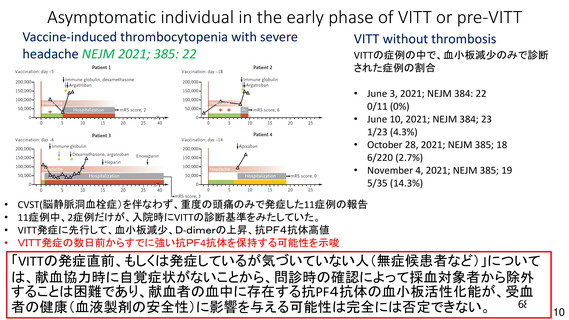
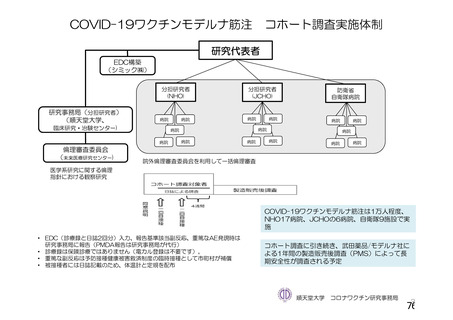
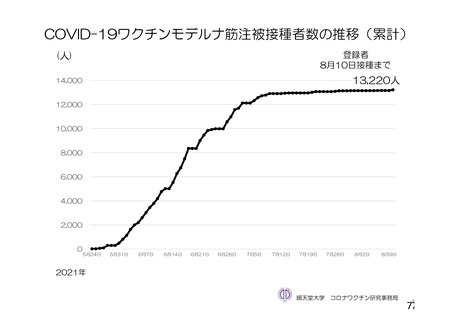
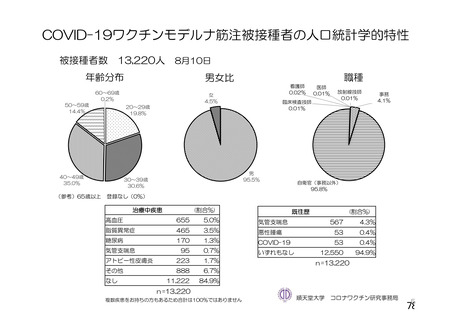
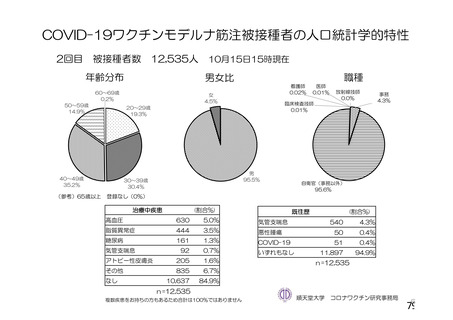
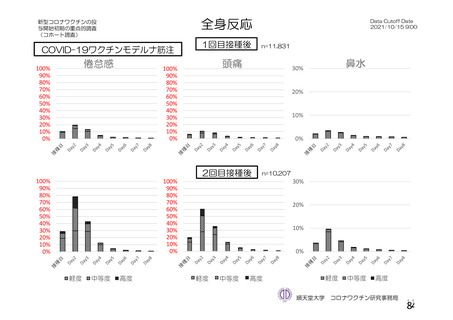
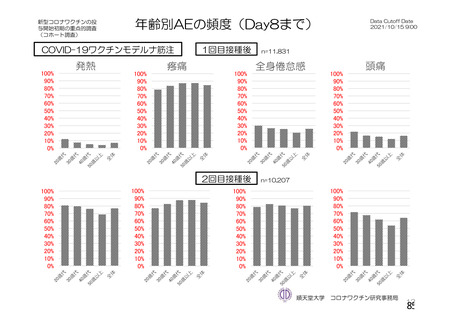
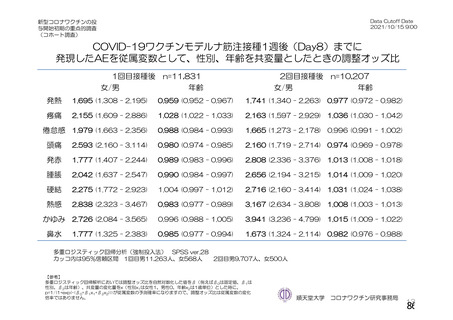
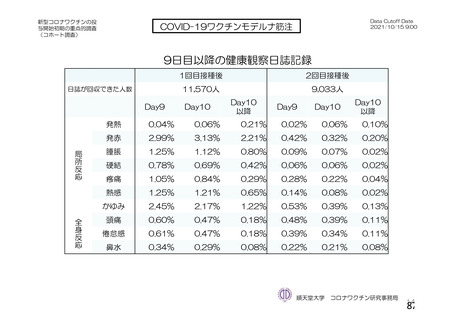
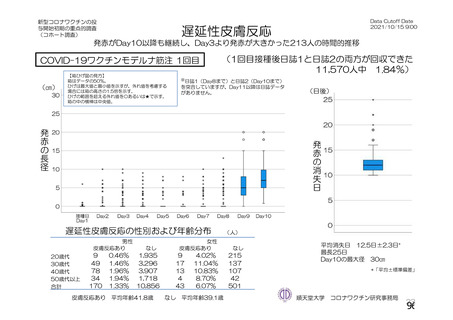
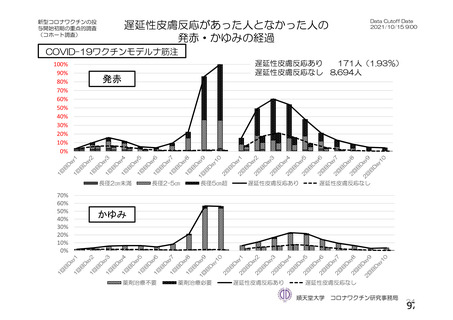
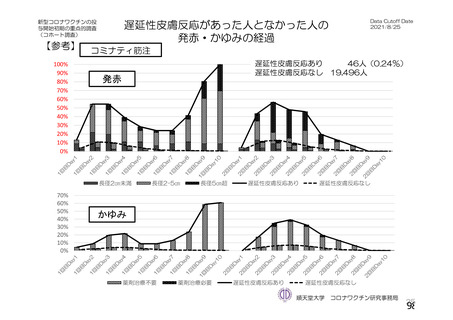
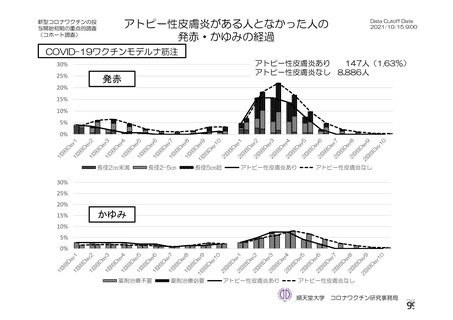
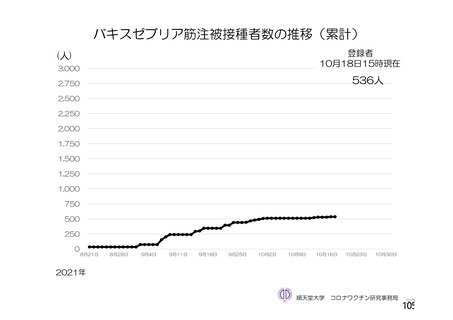
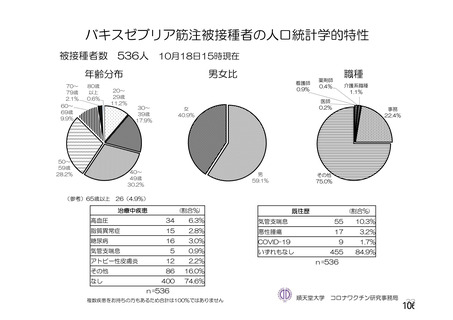
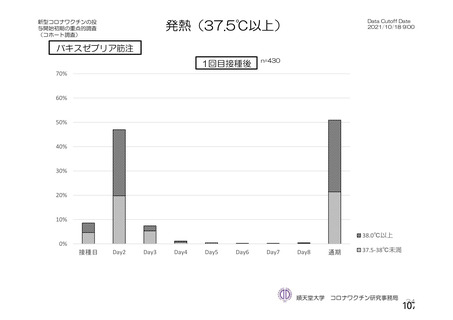
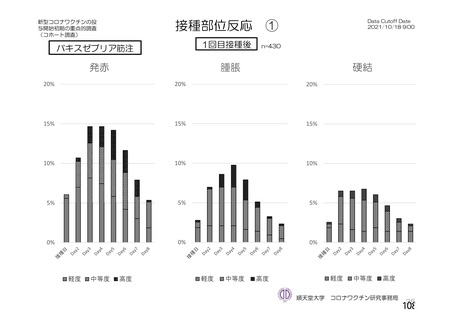
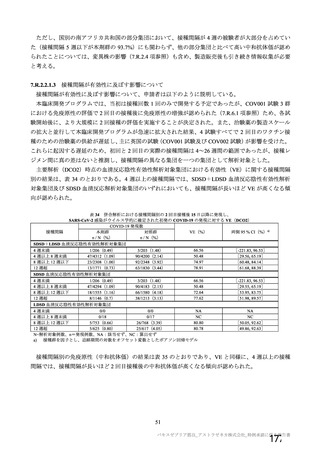
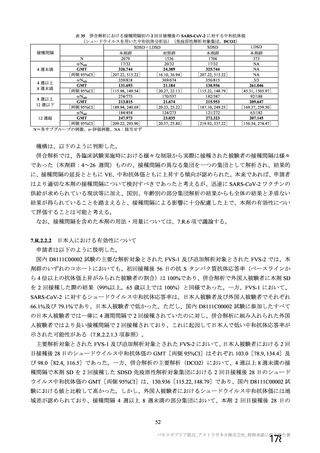
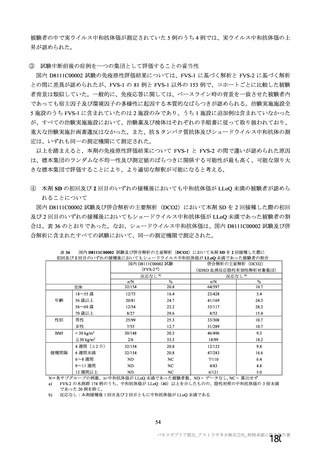
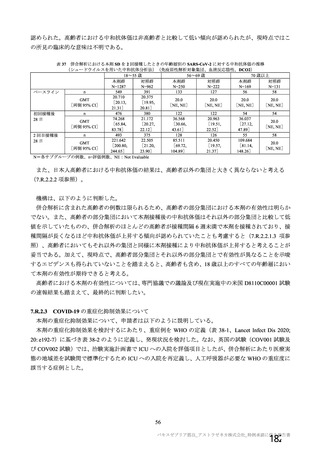
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (134 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
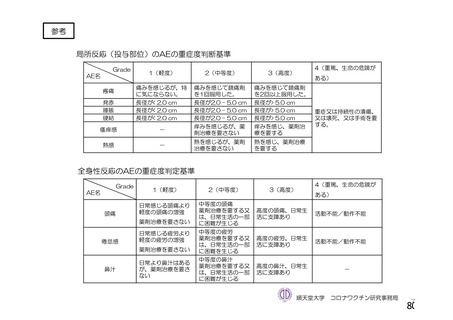
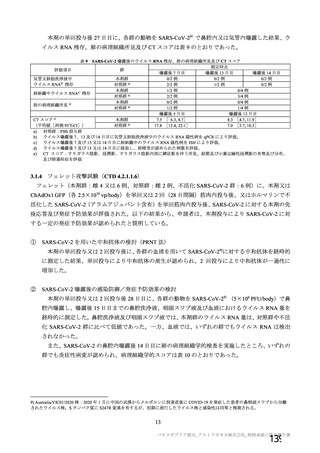
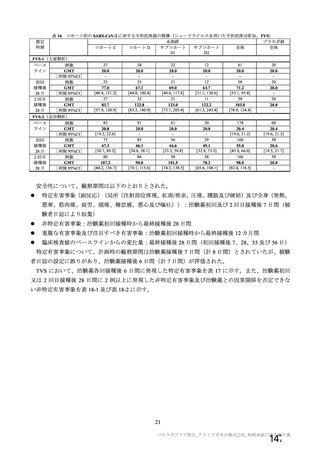
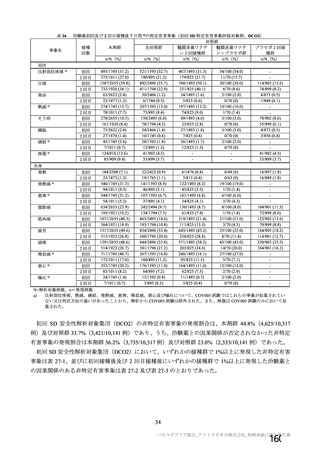
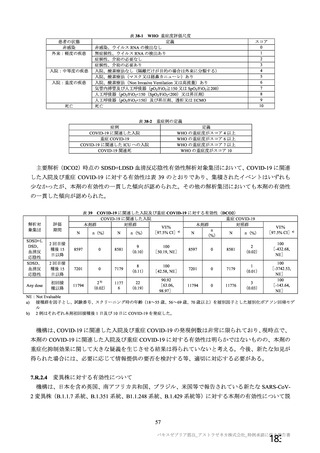
試験項目 MVS
確認試験 (PCR)
導入遺伝子配列
特性解析 全ヌクレオチド配列
感染価
ベクター粒子濃度 (qPCR)
微生物限度試験
二度論 エンドトキシン試験
〇 : 実施した項目、一 : 実施していない項目
ololololi loloは
て2
O1OIOIOIOIO 1O
2.1.3 製造方法 」
原薬の製造工程は、細胞融解、種培養、バイオリアクター拡大培養、還証還証雇較及 び生産培療、較
還深解及び証還還還還証還目、還証四、還証証証証較クロマトグラフィー、渡縮及び限外ろる過、薬液調
製、ろる過及び充填、凍結、並びに保管及び試験の各工程からなる。原楽は、半還還還還還還証較婦の容
器にて一90て一55Cで保存される。 重要工程は、還軒還還還較 〇証証証還、還議浴針火び証証還還較
還証昌、還証、還還還還証畔クロマトグラフィー、国還炎び証証証還、還証証較及び証較と されてい
る。
原薬の製造工程について、実生産スケールでプロセスバリデーションが実施されている。
2.1.4 外来性感染性物質の安全性評価
原薬の製造工程において、製造用細胞である HEK293T-REx 細胞以外の生物由来原料は使用されてい
ない。HEK293T-REx 細胞は、生物由来原料基準に適合することが確認されている。
MCB の調製時に、無菌試験、マイコバクテリア否定試験、マイコプラズマ否定試験、還還還還還還
否定試験、ウイルス様粒子の混入、x yjo 外来性ウイルス試験 (に請語記号本 HEK293 和
胞) 、ヵ vivo 外来性ウイルス試験 (男還還還還、還証還還間、還証還証還) 、了較ウイルス厨定試験
(男還還較請還還還ツイルス 、開症還還還還ウツイルス目上上及び上 間証当還証較ウイルス目還及び目較
国有還証請較ツイルス上還及び目間、還還還還還ウイル> 還証) 、還較ウイルス五定試験 (還計上
還証還還較ウイルス目較及び肖間、思詩) 及O証田 ウイルス厨定試験 (9CFR で規定されたウイルス )
が実施され、いずれも外来性感染物質による汚染は認められなかった。
また、実生産スケールで得られた生産培養の培養液について、外来性ウイルス人否定試験、マイコプラ
ズマ否定試験、マイコバクテリア否定試験、微生物限度試験、RCA 否定試験 、還還還還還還四
較合定試験肥び 較請計 否定試験が実施され、いずれも陰性であった。なお、生産培養における細胞培養
液について、外来性ウイルス否定試験 (ヵ yzo 及び か vo) 、微生物限度試験、マイコプラズマ耕定試
験、マイコバクテリア否定試験、RCA 否定試験 、還還還還還還還還還還症全所肉及び 還議 否定試
験が工程内管理試験として設定されている。
2.1.5 製造工程の開発の経緯
原薬の開発過程における製造方法の主な変更点は、表 2 のとおりである。非臨床試験及び初期の臨床
試験で用いられた原薬は製法 s により、臨床試験で用いられた原楽は製法b 及び製法cにより、市販予
定製剤は製法 d により製造される。各製法変更にあたり、製法変更前後での原薬の品質について、ロッ
7) 9CFR で規定されたウシウイルス性下痢ウイルス、ウシアデノウイルス、ウシバパルボウイルス、ブルータングウイルス、ウジRS ウ
イルス、レオウイルス、和狂犬病ウイルス、ウみとシ伝染性鼻気管炎ウイルス、ウシパラインフルエンザウイルス (3型)
$
キスゼブリア筋生 アストラセネカ株式会社_特例下認 T3T1「