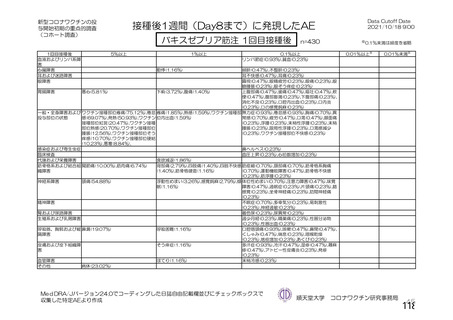
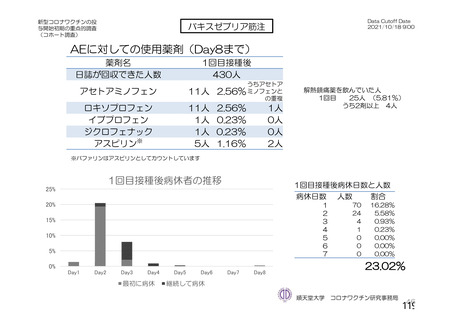
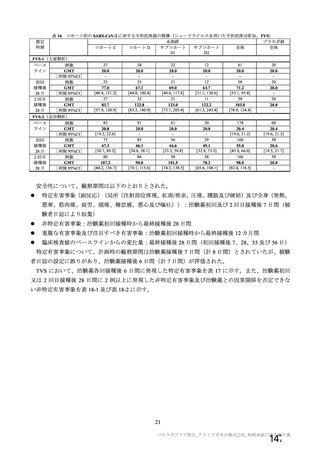
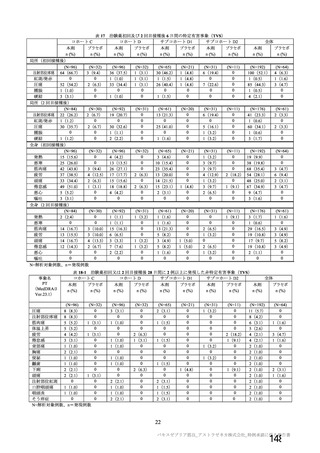
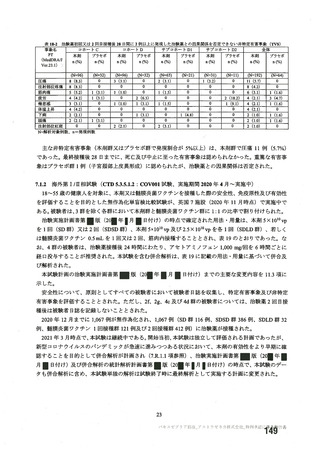
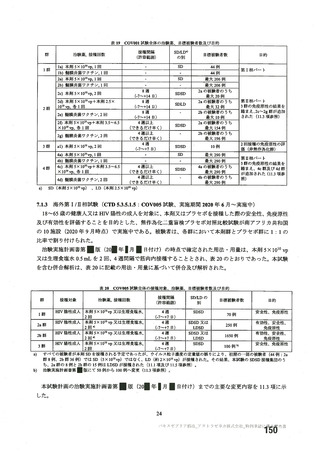
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (135 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
なお、 製法b により製造された一部の原薬において、 工程でのポリソルベート 80 の過量添加によりウ
イルス粒子濃度の定量値の誤りが生じたこと (11.5 項参照) について、 審査の項で議論する (2.R.2 項参
照)
ら
表2 原薬の製造方法の主な変更点
製法 4Dから製法 b9 ・ 画題昌の変更
・ 画還還還間及 い証還間証還間較の桶立
・ 計時証昌の交更及び証証還還のスケールテップ
・ 画還間昌還誠還還間間の肖除
・ 還還還還還還較の交下 (還是昌還還較の変更)
・証還還還還還間間間是還還較の変更 (
製法bから製法c9 ・ 画題較の変更
・語記証較のスケールアテアップ
・男還還還間間昌昌間昌間証間還還の条件変更
・還還還証還還較の交史 (還還の変更)
製法cから製法す9
の条件変更
の追加
自
・証還還還還還の交天 (凍の交東)
2.1.6 特性
2.1.6.1 構造、物理化学的性質及び生物学的性質
原薬について、表 3 に示す特性解析が実施された。
表3 特性解析の概略
項目
構造 | 一次構造 導入遺伝子配列 (サンガー法) 、S タンパク質発現條伝子 (qPCR 法) 、ウイルスゲノム遺伝子の制限酵
素マッピング、ウイルスカプシドタンパク質プロファイリング
ウイルス粒子 | 形状(透過型電子顕微鏡) 、粒子サイズバリアント (透過型電子顕微鏡、ナノ粒子トラッキング解析 (NTA) 、
モル分子基 (FFF-MALS) 、分光法 A320A260 比、超遠心分析 (AUC) )
生物学的性質 感染価 (アデノウイルス Hexon の免疫染色法) 、ACE2 と結合する 8 タンパク質のイムノアッセイ
2.1.6.2 目的物質関連物質目的物質由来不純物
目的物質由来不純物は、ウイルス粒子の区集体、ウイルス粒子の断片、挿入遺伝子を含まない空ウイ
ルス粒子、 不完全な挿入遺伝子を含むらウイルス簿子、 非感染性ウイルス粒子及びRCA とされた。ウイル
ス粒子の凝集体、ウイルス粒子の断片、挿入遺伝子を含まない空ウイルス粒子、不完全な挿入遺伝子を
含なウイルス粒子及び非感染性ウイルス粒子は、原薬及び製剤の規格及び試験方法により適切に管理さ
れている。また、RCA は原薬の工程内管理試験により適切に管理されている。
2.1.6.3 製造工程由来不純物
製造工程由来不純物は、和宿主細胞由来 *ma*、 宿主細胞由来 不純物B* 、 不純物C" 、不純物の
不純物E* 及び 不純物F* とされた。 宿主細胞由来ww"、 宿主細胞由来 不純物B* 及び
6 *新薬承認情報提供時に置き換え
バキスゼブリア筋注- アストラゼネカカ株式会社 特例 や132”