よむ、つかう、まなぶ。
総-1-2再生医療等製品「エレビジス点滴静注」の安全対策について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
7 . 1 O . 8
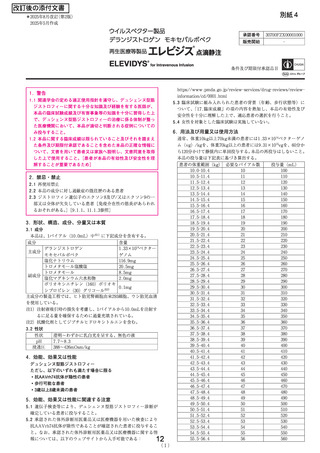
再生医療等製品「エレビジス点滴静注」の
安全対策について
医薬局医薬安全対策課
1. 背景
〇O 「エレビジス点滴静注」(本品) は、デュシェンヌ型筋ジストロフィー
(DMD) 患者に用いられる再生医療等製品として本年5月 13 日に条件及び期
限付承認されたが、6月 16 日に本品の製造販売業者が以下の安全性情報を
発表した。
・ 海外の歩行不能な患者で致死的な経過を辿った急性肝不全の報告
・これにより国内で実施中の歩行不能な患者を対象と した臨床試験も投与を
中断すること。
・ (本邦で承認されている) 歩行可能な患者における本品のベネフィット・
リスクプロファイルに変更はないこと。
〇 その後、本年6月 18 日の中医協総会における、本品の保険適用に係る議
諭の進め方に係る審議の中で、1号及び2号委員から、
・本品を承認した制度は、有効性は推定であるものの、安全性を認める場合
に早期に条件付きで承認を与えるもの。
・本制度の大前提となる安全性が揺らいでいることから、承認された使用方
法や対象患者の設定なども含め、薬事で専門的に再検討していただくこと
も含め、厚生労働省としてしっかり情報収集、整理した上で、丁寧で慎重
な検討が必要。
・ 保険給付をする限りは、最低限、安全性の担保は不可欠であり、メーカー
と厚労独におかれては、速やかに安全性の確認をお願いしたい、。
とのご意見をいただいた。
| 2 . 安全性情報の概要
O 歩行不能な患者を対象とした臨床試験の中断等の根拠となった安全性情報
として製造販売業者から報告された症例は、海外において2例発生した急性
肝不全の死亡例であり、いずれも (本品の効能、効果又は性能の対象である
歩行可能な患者ではない) 歩行不能患者における報告であった。 具体的な症
例経過は別紙 1のとおり。
再生医療等製品「エレビジス点滴静注」の
安全対策について
医薬局医薬安全対策課
1. 背景
〇O 「エレビジス点滴静注」(本品) は、デュシェンヌ型筋ジストロフィー
(DMD) 患者に用いられる再生医療等製品として本年5月 13 日に条件及び期
限付承認されたが、6月 16 日に本品の製造販売業者が以下の安全性情報を
発表した。
・ 海外の歩行不能な患者で致死的な経過を辿った急性肝不全の報告
・これにより国内で実施中の歩行不能な患者を対象と した臨床試験も投与を
中断すること。
・ (本邦で承認されている) 歩行可能な患者における本品のベネフィット・
リスクプロファイルに変更はないこと。
〇 その後、本年6月 18 日の中医協総会における、本品の保険適用に係る議
諭の進め方に係る審議の中で、1号及び2号委員から、
・本品を承認した制度は、有効性は推定であるものの、安全性を認める場合
に早期に条件付きで承認を与えるもの。
・本制度の大前提となる安全性が揺らいでいることから、承認された使用方
法や対象患者の設定なども含め、薬事で専門的に再検討していただくこと
も含め、厚生労働省としてしっかり情報収集、整理した上で、丁寧で慎重
な検討が必要。
・ 保険給付をする限りは、最低限、安全性の担保は不可欠であり、メーカー
と厚労独におかれては、速やかに安全性の確認をお願いしたい、。
とのご意見をいただいた。
| 2 . 安全性情報の概要
O 歩行不能な患者を対象とした臨床試験の中断等の根拠となった安全性情報
として製造販売業者から報告された症例は、海外において2例発生した急性
肝不全の死亡例であり、いずれも (本品の効能、効果又は性能の対象である
歩行可能な患者ではない) 歩行不能患者における報告であった。 具体的な症
例経過は別紙 1のとおり。