よむ、つかう、まなぶ。
資料3-4トラメチニブ ジメチルスルホキシド付加物[637KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-179
められた主な有害事象は、概ね既知の有害事象であり、新たな安全性シグナルは認め
られなかった。
医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」
)は、上記の企業
見解を提出した企業の有効性及び安全性に係る説明に加え、以下の点を確認した。
国内外の臨床試験で認められた有害事象は、概ね本邦の添付文書で既に注意喚起され
ている事象である。
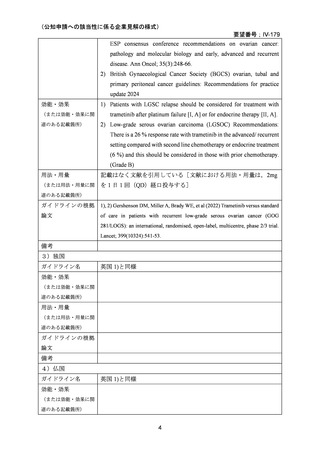
米国では 2013 年、欧州では 2014 年に承認される等、使用実績が蓄積されている。
以上より、検討会議は、本邦において本薬は再審査期間中1であり、日本人における安全
性の情報収集等を継続する必要はあるものの、がん化学療法後に増悪した低異型度漿液性
卵巣癌に対する本薬の臨床的有用性は、本報告書に記載した情報により説明可能であるこ
とから、追加の臨床試験を実施することなく、本検討会議の公知申請の枠組みで対応可能
と判断した。
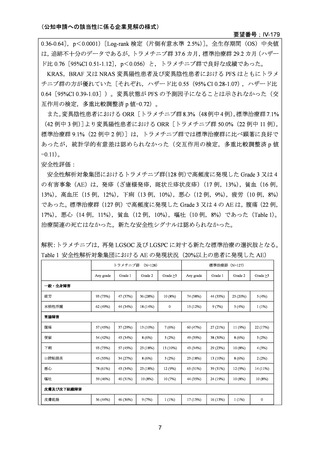
4.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果については、以下のように設定することが適当と検討会議は考える。
【効能・効果】
(要望内容に関連する部分のみ抜粋)
がん化学療法後に増悪した低異型度漿液性卵巣癌
【効能・効果に関連する注意】(要望内容に関連する部分のみ抜粋)
〈低異型度漿液性卵巣癌〉
・本剤の手術の補助療法における有効性及び安全性は確立していない。
【設定の妥当性について】
本報告書に記載した情報に基づき、遺伝子変異型によらず、がん化学療法後に増悪した
低異型度漿液性卵巣癌(腹膜癌、卵管癌及び卵巣癌)に対する本薬の臨床的有用性は、説
明可能と考える(3.
「公知申請の妥当性について」の項参照)ことから、上記のとおり設
定することが適切と判断した。
(2)用法・用量について
1
承認条件として、
「医薬品リスク管理計画を策定の上、適切に実施すること。
」が付され、安全性検討事項とし
て、心臓障害、眼障害、肝機能障害、横紋筋融解症、発熱、深部静脈血栓症及び肺塞栓症、間質性肺疾患、脳
血管障害(脳出血、脳血管発作等)
、腎機能障害、受胎能の低下、胚・胎児発生に対する影響、成長発達障害
が設定されている。初回承認時に付された再審査期間は 2026 年 3 月 27 日に終了予定。
2
められた主な有害事象は、概ね既知の有害事象であり、新たな安全性シグナルは認め
られなかった。
医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」
)は、上記の企業
見解を提出した企業の有効性及び安全性に係る説明に加え、以下の点を確認した。
国内外の臨床試験で認められた有害事象は、概ね本邦の添付文書で既に注意喚起され
ている事象である。
米国では 2013 年、欧州では 2014 年に承認される等、使用実績が蓄積されている。
以上より、検討会議は、本邦において本薬は再審査期間中1であり、日本人における安全
性の情報収集等を継続する必要はあるものの、がん化学療法後に増悪した低異型度漿液性
卵巣癌に対する本薬の臨床的有用性は、本報告書に記載した情報により説明可能であるこ
とから、追加の臨床試験を実施することなく、本検討会議の公知申請の枠組みで対応可能
と判断した。
4.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果については、以下のように設定することが適当と検討会議は考える。
【効能・効果】
(要望内容に関連する部分のみ抜粋)
がん化学療法後に増悪した低異型度漿液性卵巣癌
【効能・効果に関連する注意】(要望内容に関連する部分のみ抜粋)
〈低異型度漿液性卵巣癌〉
・本剤の手術の補助療法における有効性及び安全性は確立していない。
【設定の妥当性について】
本報告書に記載した情報に基づき、遺伝子変異型によらず、がん化学療法後に増悪した
低異型度漿液性卵巣癌(腹膜癌、卵管癌及び卵巣癌)に対する本薬の臨床的有用性は、説
明可能と考える(3.
「公知申請の妥当性について」の項参照)ことから、上記のとおり設
定することが適切と判断した。
(2)用法・用量について
1
承認条件として、
「医薬品リスク管理計画を策定の上、適切に実施すること。
」が付され、安全性検討事項とし
て、心臓障害、眼障害、肝機能障害、横紋筋融解症、発熱、深部静脈血栓症及び肺塞栓症、間質性肺疾患、脳
血管障害(脳出血、脳血管発作等)
、腎機能障害、受胎能の低下、胚・胎児発生に対する影響、成長発達障害
が設定されている。初回承認時に付された再審査期間は 2026 年 3 月 27 日に終了予定。
2