よむ、つかう、まなぶ。
資料3-4トラメチニブ ジメチルスルホキシド付加物[637KB] (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(公知申請への該当性に係る企業見解の様式)
要望番号;IV-179
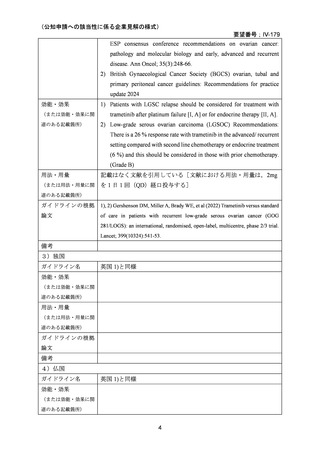
織病理学,免疫組織化学的検査,及び分子遺伝学的解析に基づき,主に 5 つのサブタイプ
(高異型度漿液性腺癌,類内膜癌,明細胞癌,粘液癌,低異型度漿液性腺癌)に分けら
れ,LGSC に分類される卵巣癌,卵管癌,及び腹膜癌については,NCCN 治療ガイドライ
ン及び卵巣がん・卵管癌・腹膜癌治療ガイドライン 2020 年版では同じ治療アプローチが
推奨されている。したがって,再発 LGSFTC に対してもトラメチニブの有効性が期待で
きると考えることは妥当である。
また,トラメチニブの既承認効能における有効性及び薬物動態の結果に国内外で明らか
な差異は報告されていないこと,LGSC の病態に民族差は報告されていないこと等から,
日本人再発 LGSC 患者に対してもトラメチニブの有効性が期待できると考えられる。
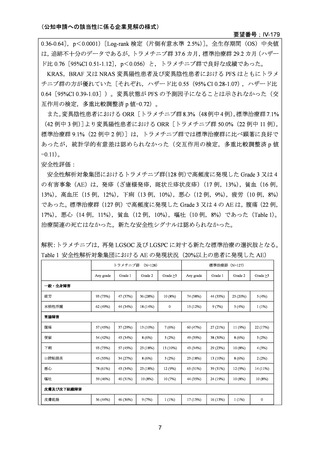
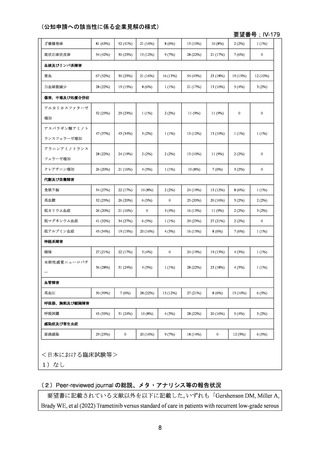
本邦においては,NCCH1901 患者申出療養のトラメチニブ群に日本人再発 LGSOC 患者 5
例が登録され,トラメチニブ 2 mg QD 投与時の BOR は 2 例が PR,3 例が SD であり,ORR
は 40.0%であった。評価例数は限定的であり,また GOG 281/LOGS 試験では遺伝子変異の
状態を問わない患者集団であったのに対し,当該プログラムに登録された患者は遺伝子変
異陽性集団で,患者集団の背景に違いはあるものの,日本人再発 LGSOC 患者に対するト
ラメチニブの有効性が示されたと考えられる。なお,いずれの患者も薬物治療歴を有する
が,再発時期に関する詳細なデータは収集していない。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
GOG 281/LOGS 試験の結果,外国人再発 LGSC 患者集団におけるトラメチニブの忍容性
は良好であると考えられる。トラメチニブの既承認効能及び単剤投与時における安全性及
び薬物動態の結果に国内外で明らかな差異は報告されていないことから,日本人再発 LGSC
患者における忍容性も良好であると考えられる。
本邦においては,NCCH1901 患者申出療養のトラメチニブ群において,再発 LGSOC 患者
5 例を含む 59 例の日本人患者にトラメチニブ 2 mg QD の投与が行われた。2 mg QD は既承
認効能に対する添付文書の用量範囲内である。トラメチニブ群全体で報告された安全性プ
ロファイルは,過去の臨床試験でみられたトラメチニブ単剤投与時の安全性プロファイル
と大きな違いはなかった。
したがって,トラメチニブの合理的かつ十分に理解されている作用機序及び他の癌腫も
含めた単剤投与時の臨床データ,並びにダブラフェニブ併用投与時の臨床使用経験により,
日本人再発 LGSC 患者においても安全性に問題ないと考えられる。
(3)要望内容に係る公知申請の妥当性について
LGSC は進行期に診断されることが稀ではなく,その結果,長期予後が不良となる致死
的な疾患である(UpToDate 2024)。腫瘍の増殖が緩徐であるため,プラチナ製剤をベース
とする化学療法に対して感受性が低い。現時点では有効な治療選択肢に乏しく,高いアン
メットメディカルニーズが存在する。トラメチニブは海外において再発 LGSC に対して標
12
要望番号;IV-179
織病理学,免疫組織化学的検査,及び分子遺伝学的解析に基づき,主に 5 つのサブタイプ
(高異型度漿液性腺癌,類内膜癌,明細胞癌,粘液癌,低異型度漿液性腺癌)に分けら
れ,LGSC に分類される卵巣癌,卵管癌,及び腹膜癌については,NCCN 治療ガイドライ
ン及び卵巣がん・卵管癌・腹膜癌治療ガイドライン 2020 年版では同じ治療アプローチが
推奨されている。したがって,再発 LGSFTC に対してもトラメチニブの有効性が期待で
きると考えることは妥当である。
また,トラメチニブの既承認効能における有効性及び薬物動態の結果に国内外で明らか
な差異は報告されていないこと,LGSC の病態に民族差は報告されていないこと等から,
日本人再発 LGSC 患者に対してもトラメチニブの有効性が期待できると考えられる。
本邦においては,NCCH1901 患者申出療養のトラメチニブ群に日本人再発 LGSOC 患者 5
例が登録され,トラメチニブ 2 mg QD 投与時の BOR は 2 例が PR,3 例が SD であり,ORR
は 40.0%であった。評価例数は限定的であり,また GOG 281/LOGS 試験では遺伝子変異の
状態を問わない患者集団であったのに対し,当該プログラムに登録された患者は遺伝子変
異陽性集団で,患者集団の背景に違いはあるものの,日本人再発 LGSOC 患者に対するト
ラメチニブの有効性が示されたと考えられる。なお,いずれの患者も薬物治療歴を有する
が,再発時期に関する詳細なデータは収集していない。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
GOG 281/LOGS 試験の結果,外国人再発 LGSC 患者集団におけるトラメチニブの忍容性
は良好であると考えられる。トラメチニブの既承認効能及び単剤投与時における安全性及
び薬物動態の結果に国内外で明らかな差異は報告されていないことから,日本人再発 LGSC
患者における忍容性も良好であると考えられる。
本邦においては,NCCH1901 患者申出療養のトラメチニブ群において,再発 LGSOC 患者
5 例を含む 59 例の日本人患者にトラメチニブ 2 mg QD の投与が行われた。2 mg QD は既承
認効能に対する添付文書の用量範囲内である。トラメチニブ群全体で報告された安全性プ
ロファイルは,過去の臨床試験でみられたトラメチニブ単剤投与時の安全性プロファイル
と大きな違いはなかった。
したがって,トラメチニブの合理的かつ十分に理解されている作用機序及び他の癌腫も
含めた単剤投与時の臨床データ,並びにダブラフェニブ併用投与時の臨床使用経験により,
日本人再発 LGSC 患者においても安全性に問題ないと考えられる。
(3)要望内容に係る公知申請の妥当性について
LGSC は進行期に診断されることが稀ではなく,その結果,長期予後が不良となる致死
的な疾患である(UpToDate 2024)。腫瘍の増殖が緩徐であるため,プラチナ製剤をベース
とする化学療法に対して感受性が低い。現時点では有効な治療選択肢に乏しく,高いアン
メットメディカルニーズが存在する。トラメチニブは海外において再発 LGSC に対して標
12