よむ、つかう、まなぶ。
資料3-4トラメチニブ ジメチルスルホキシド付加物[637KB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(公知申請への該当性に係る企業見解の様式)
要望番号;IV-179
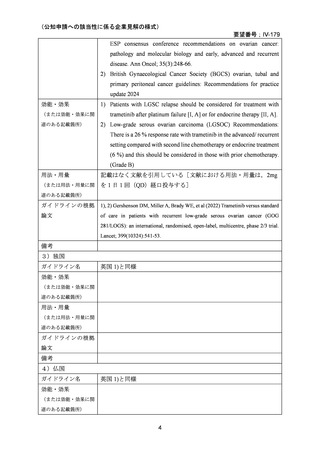
投与する。なお,患者の状態により適宜減量する。」としている。
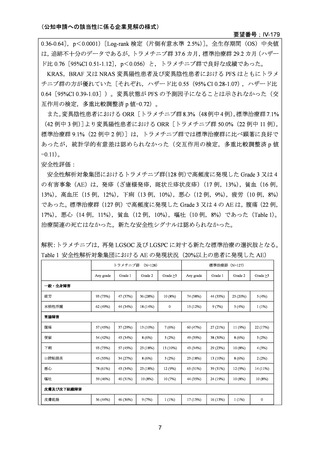
GOG 281/LOGS 試験での用法・用量はトラメチニブ 2 mg QD で実施され,再発 LGSOC
及び LGSPC 患者において有効性が示された。本邦で実施された NCCH1901 患者申出療養
でのトラメチニブの用法・用量は添付文書における既承認効能での用法・用量に従ってお
り,日本人再発 LGSOC 患者 5 例にトラメチニブ 2 mg QD の投与が行われている。評価例
数は限定的であるものの,当該用法・用量における日本人再発 LGSOC 患者に対するトラ
メチニブの有効性が示されたと考えられる。
安全性については,当該用法・用量における国内外の臨床試験のトラメチニブ単剤投与
時の安全性プロファイルと同様であると考えられる(「5.要望内容に係る国内外の公表文
献・成書等について」参照)。NCCH1901 患者申出療養において添付文書に従い有効性及び
患者の状態に応じて用量調節が実施された。したがって,既承認効能と同様に,患者の状
態に応じて適宜減量しながらトラメチニブを継続することは妥当であると考える。
以上より,用法・用量に関しては,海外で十分なエビデンスがあり,日本人においても
同様の有効性が期待でき,かつ安全性プロファイルも同様であると考えられる海外での用
法・用量と同じ「通常,成人にはトラメチニブとして 2 mg を 1 日 1 回,空腹時に経口投与
する。なお,患者の状態により適宜減量する。」が妥当と考える。また,用法・用量に関連
する注意は,既承認効能のうち成人のみを対象として設定した注意事項と同様に設定する
ことが適切であると考える。ただし,7.2 項にある「有棘細胞癌(皮膚の扁平上皮癌)又は
新たな原発性悪性黒色腫」に対する注意喚起は,ダブラフェニブとの併用時のダブラフェ
ニブに起因する注意であることから,「ダブラフェニブとの併用において」と明記すること
とした。また,当該効能については,他の抗悪性腫瘍剤との併用時の評価を行っていないこ
とから,「他の抗悪性腫瘍剤を併用した場合の有効性及び安全性は確立していない。」と設
定することが適切であると考える。
(3)上記(1)及び(2)以外の添付文書の記載内容について
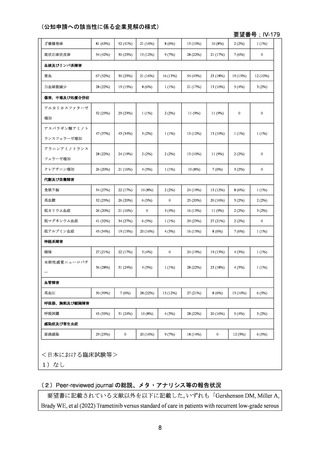
1)国内外の添付文書の記載内容(注意喚起等)の異同について
欧米等 6 か国において本効能は承認されていない。
2)上記1)以外で本邦の添付文書上で改訂が必要と考えられる箇所の有無について
5 効能又は効果に関連する注意の項において,効能共通の項目として,以下の注意を記載
しているが,当該記載は開発要請のあった効能には該当しない注意事項となるため,共通
ではなく効能毎の注意事項にする必要がある。
・十分な経験を有する病理医又は検査施設における検査により、BRAF 遺伝子変異が確認さ
れた患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器
を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、
以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
15
要望番号;IV-179
投与する。なお,患者の状態により適宜減量する。」としている。
GOG 281/LOGS 試験での用法・用量はトラメチニブ 2 mg QD で実施され,再発 LGSOC
及び LGSPC 患者において有効性が示された。本邦で実施された NCCH1901 患者申出療養
でのトラメチニブの用法・用量は添付文書における既承認効能での用法・用量に従ってお
り,日本人再発 LGSOC 患者 5 例にトラメチニブ 2 mg QD の投与が行われている。評価例
数は限定的であるものの,当該用法・用量における日本人再発 LGSOC 患者に対するトラ
メチニブの有効性が示されたと考えられる。
安全性については,当該用法・用量における国内外の臨床試験のトラメチニブ単剤投与
時の安全性プロファイルと同様であると考えられる(「5.要望内容に係る国内外の公表文
献・成書等について」参照)。NCCH1901 患者申出療養において添付文書に従い有効性及び
患者の状態に応じて用量調節が実施された。したがって,既承認効能と同様に,患者の状
態に応じて適宜減量しながらトラメチニブを継続することは妥当であると考える。
以上より,用法・用量に関しては,海外で十分なエビデンスがあり,日本人においても
同様の有効性が期待でき,かつ安全性プロファイルも同様であると考えられる海外での用
法・用量と同じ「通常,成人にはトラメチニブとして 2 mg を 1 日 1 回,空腹時に経口投与
する。なお,患者の状態により適宜減量する。」が妥当と考える。また,用法・用量に関連
する注意は,既承認効能のうち成人のみを対象として設定した注意事項と同様に設定する
ことが適切であると考える。ただし,7.2 項にある「有棘細胞癌(皮膚の扁平上皮癌)又は
新たな原発性悪性黒色腫」に対する注意喚起は,ダブラフェニブとの併用時のダブラフェ
ニブに起因する注意であることから,「ダブラフェニブとの併用において」と明記すること
とした。また,当該効能については,他の抗悪性腫瘍剤との併用時の評価を行っていないこ
とから,「他の抗悪性腫瘍剤を併用した場合の有効性及び安全性は確立していない。」と設
定することが適切であると考える。
(3)上記(1)及び(2)以外の添付文書の記載内容について
1)国内外の添付文書の記載内容(注意喚起等)の異同について
欧米等 6 か国において本効能は承認されていない。
2)上記1)以外で本邦の添付文書上で改訂が必要と考えられる箇所の有無について
5 効能又は効果に関連する注意の項において,効能共通の項目として,以下の注意を記載
しているが,当該記載は開発要請のあった効能には該当しない注意事項となるため,共通
ではなく効能毎の注意事項にする必要がある。
・十分な経験を有する病理医又は検査施設における検査により、BRAF 遺伝子変異が確認さ
れた患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器
を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、
以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
15