よむ、つかう、まなぶ。
資料3-4トラメチニブ ジメチルスルホキシド付加物[637KB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(公知申請への該当性に係る企業見解の様式)
要望番号;IV-179
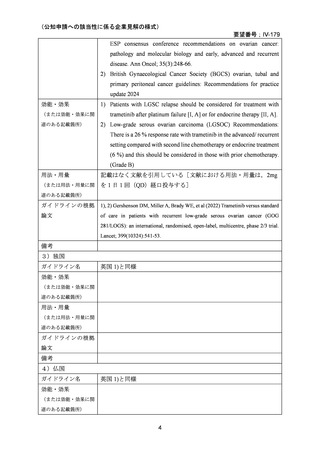
<文献の検索方法(検索式や検索時期等),検索結果,文献等の選定理由の概略等>
PubMed において,「“trametinib” AND “low grade serous carcinoma”」を検索式として
2024 年 10 月に検索したが,要望書に記載された[Gershenson DM, Miller A, Brady WE, et al
(2022) Trametinib versus standard of care in patients with recurrent low-grade serous ovarian cancer
(GOG 281/LOGS): an international, randomised, open-label, multicentre, phase 2/3 trial. Lancet;
399(10324):541-53.]以外のものは該当しなかった。
<海外における臨床試験等>
1 ) Gershenson DM, Miller A, Brady WE, et al (2022) Trametinib versus standard of care in
patients with recurrent low-grade serous ovarian cancer (GOG 281/LOGS): an international,
randomised, open-label, multicentre, phase 2/3 trial. Lancet; 399(10324):541-53.
試験の種類:ランダム化非盲検多施設共同第 2/3 相医師主導(IIT)試験
対象:18 歳以上の再発 LGSOC 又は LGSPC 患者
主要評価項目:intention-to-treat 集団に対して治験責任医師が評価した無増悪生存期間
(PFS)
方法:本試験はトラメチニブ群(130 例)と標準治療群(130 例)の比較試験である。以下
にトラメチニブ及び標準治療群の各薬剤の用法・用量を記載した。
•
トラメチニブの用法・用量:2 mg を 1 日 1 回(QD)経口投与
•
標準治療群である各薬剤の用法・用量:
o
パクリタキセル:80 mg/m2 を 28 日間サイクルの 1 日目,8 日目,15 日目に
静脈内投与
o
ペグ化リポソーマルドキソルビシン:40-50 mg/m 2 を 4 週間に 1 回静脈内投
与
o
トポテカン:4 mg/m2 を 28 日間サイクルの 1 日目,8 日目,15 日目に静脈内
投与
o
レトロゾール:2.5 mg を QD 経口投与
o
タモキシフェン:20 mg を 1 日 2 回経口投与
結果:
トラメチニブ群に 130 例(年齢中央値:55.3 歳),標準治療群に 130 例(年齢中央値:
56.6 歳)が登録された。KRAS,BRAF,又は NRAS 遺伝子変異陽性患者は,トラメチニブ
群 22 例(17%)標準治療群 22 例(17%),遺伝子変異陰性患者はそれぞれ 42 例(32%),48
例(37%)であった。
有効性評価:
主要解析では,217 件の PFS イベント[トラメチニブ群 101 例(78%),標準治療群 116
例(89%)]が発生した。トラメチニブ群の PFS 中央値は 13.0 カ月(95%CI 9.9-15.0)であ
ったのに対し,標準治療群では 7.2 カ月(95%CI 5.6-9.9)であった(ハザード比 0.48[95%CI
6
要望番号;IV-179
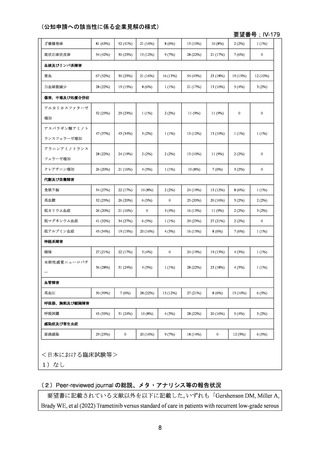
<文献の検索方法(検索式や検索時期等),検索結果,文献等の選定理由の概略等>
PubMed において,「“trametinib” AND “low grade serous carcinoma”」を検索式として
2024 年 10 月に検索したが,要望書に記載された[Gershenson DM, Miller A, Brady WE, et al
(2022) Trametinib versus standard of care in patients with recurrent low-grade serous ovarian cancer
(GOG 281/LOGS): an international, randomised, open-label, multicentre, phase 2/3 trial. Lancet;
399(10324):541-53.]以外のものは該当しなかった。
<海外における臨床試験等>
1 ) Gershenson DM, Miller A, Brady WE, et al (2022) Trametinib versus standard of care in
patients with recurrent low-grade serous ovarian cancer (GOG 281/LOGS): an international,
randomised, open-label, multicentre, phase 2/3 trial. Lancet; 399(10324):541-53.
試験の種類:ランダム化非盲検多施設共同第 2/3 相医師主導(IIT)試験
対象:18 歳以上の再発 LGSOC 又は LGSPC 患者
主要評価項目:intention-to-treat 集団に対して治験責任医師が評価した無増悪生存期間
(PFS)
方法:本試験はトラメチニブ群(130 例)と標準治療群(130 例)の比較試験である。以下
にトラメチニブ及び標準治療群の各薬剤の用法・用量を記載した。
•
トラメチニブの用法・用量:2 mg を 1 日 1 回(QD)経口投与
•
標準治療群である各薬剤の用法・用量:
o
パクリタキセル:80 mg/m2 を 28 日間サイクルの 1 日目,8 日目,15 日目に
静脈内投与
o
ペグ化リポソーマルドキソルビシン:40-50 mg/m 2 を 4 週間に 1 回静脈内投
与
o
トポテカン:4 mg/m2 を 28 日間サイクルの 1 日目,8 日目,15 日目に静脈内
投与
o
レトロゾール:2.5 mg を QD 経口投与
o
タモキシフェン:20 mg を 1 日 2 回経口投与
結果:
トラメチニブ群に 130 例(年齢中央値:55.3 歳),標準治療群に 130 例(年齢中央値:
56.6 歳)が登録された。KRAS,BRAF,又は NRAS 遺伝子変異陽性患者は,トラメチニブ
群 22 例(17%)標準治療群 22 例(17%),遺伝子変異陰性患者はそれぞれ 42 例(32%),48
例(37%)であった。
有効性評価:
主要解析では,217 件の PFS イベント[トラメチニブ群 101 例(78%),標準治療群 116
例(89%)]が発生した。トラメチニブ群の PFS 中央値は 13.0 カ月(95%CI 9.9-15.0)であ
ったのに対し,標準治療群では 7.2 カ月(95%CI 5.6-9.9)であった(ハザード比 0.48[95%CI
6