よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
9.適用上の注意
1)調製方法
(1)プランジャーロッドを添付溶解液の針付き注射器型容器
にねじ込み取り付ける。
(2)針付き注射器型容器のニードルシールド(針カバー)をは
ずし、バイアルに溶解液をゆっくり加えた後、静かに円
を描くように回して溶解すること(激しく振とうしないこ
と)。
(3)添付溶解液は、残さず全量をバイアルに注入すること。
(4)添付溶解液の針付き注射器型容器の針先には十分注意し、
注射には使用しないこと。
(5)完全に溶けなかった場合、又は浮遊物が見られた場合は
使用しないこと。
2)溶解後の保存方法
溶解後は2〜8℃で遮光保存し、42日以内に使用すること(溶
解後凍結した場合は使用しないこと)。
3)筋肉内注射時
筋肉内注射する場合には、組織・神経等への影響を避ける
ため、下記の点に注意すること。
(1)同一部位への反復注射は行わないこと。
(2)神経走行部位を避けること。
(3)注射針を刺入したとき、激痛を訴えたり血液の逆流をみ
た場合は直ちに針を抜き、部位をかえて注射すること。
(4)注射部位に疼痛、硬結をみることがある。
4)皮下注射時
皮下注射する場合には、注射部位を上腕、大腿、腹部、臀
部等広範に求め、順序よく移動し、同一部位に短期間内に
繰返し注射しないこと。
10.その他の注意
1)
ヒト成長ホルモンと白血病の因果関係は明らかではないが、
ヒト成長ホルモンの投与を受けた患者に白血病があらわれ
たとの報告があるので、定期的に血液検査を行うなど、患
者の状態を十分に観察すること。白血病、悪性腫瘍を発生
しやすい先天異常、免疫不全症候群等の基礎疾患のある患
者、脳腫瘍などによる放射線治療歴のある患者、抗がん薬
や免疫抑制薬の投与歴のある患者、治療開始時の血液像に
異常がある患者に投与する場合には、特に患者の状態を観
察すること。
ヒト成長ホルモンの投与を受けた患者に脳腫瘍が再発した
2)
との報告がある。
3)
小児がんの既往を有する患者にヒト成長ホルモンを投与し
た場合、二次性腫瘍の発現リスクが上昇するとの報告がある。
4)
成人成長ホルモン分泌不全症患者に本剤と本剤以外のホル
モン剤を併用する場合には、併用するホルモン剤が血清IGF-Ⅰ
濃度に影響を及ぼすことがあるため、慎重に血清IGF-Ⅰ濃度
をモニタリングすること。
5)
連続投与した場合、ヒト成長ホルモンに対する抗体が生じ
ることがある。抗体の産生により効果の減弱がみられる場
合には、投与を中止し、適宜他の治療法を考慮すること。
動物実験で妊娠前、妊娠初期投与試験において、高投与量
6)
群で交尾率及び妊娠率の低下が報告されている。3)
A U C0-24h
Cmax
M R T 0-24h
(ng・hr/mL) (ng/mL) (hr)
グロウジェクト
注射用8mg
グロウジェクト
注射用1.33mg
血清中hGH濃度(ng/mL)
83.7±20.9
3.7±1.4
3.7±1.3
644.7±114.8
72.7±19.8
3.5±0.7
4.9±1.4
【臨床成績】
**
1.臨床効果
1)
成長ホルモン分泌不全性低身長症
グロウジェクト注射用8mgの臨床試験(0.175mg/kg/週)
におい
て、6ヵ月間治療した45例(新規例28例、切替例17例)
における
年間成長速度を下表に示した。5)
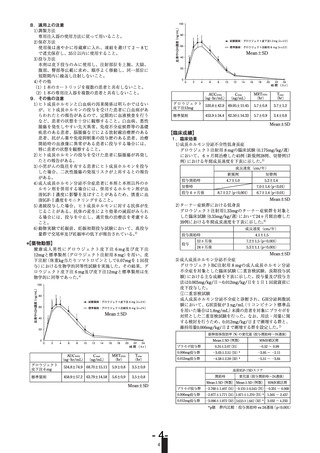
成長速度
(cm/年)
投与開始時
新規例
切替例
4.7±1.0
5.2±1.4
8.7±2.7
(p<0.001)
7.0±1.6
(p<0.01)
6.7±1.4
(p<0.01)
切替時
投与6ヵ月後
Mean±SD
2)ターナー症候群における低身長
グロウジェクト注射用1.33mgのターナー症候群を対象とし
た臨床試験(0.35mg/kg/週)において24 月間治療した39
例における年間成長速度を下表に示した。6)
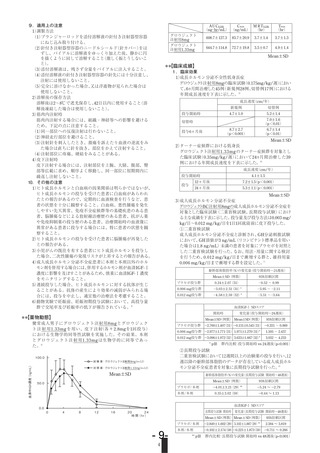
成長速度(cm/年)
投与開始時
投与
4.1±1.5
12ヵ月後
7.2±1.5
(p<0.001)
24ヵ月後
5.3±1.1
(p<0.001)
Mean±SD
3)
成人成長ホルモン分泌不全症
グロウジェクトBC注射用8mgの成人成長ホルモン分泌不全症を
対象とした臨床試験(二重盲検試験、長期投与試験)におけ
る主な成績を下表に示した。投与量及び投与方法は0.003 mg/
kg/日〜0.012 mg/kg/日を1日1回就寝前に皮下投与した。
①二重盲検試験
成人成長ホルモン分泌不全症と診断され、GH分泌刺激試験
において、GH頂値が3 ng/mL(リコンビナント標準品を用い
た場合は1.8 ng/mL)未満の患者を対象にプラセボを対照と
した二重盲検試験を行った。なお、用法・用量に関する検討
を行うため、0.012 mg/kg/日まで漸増する群と、維持用量
0.006 mg/kg/日まで漸増する群を設定した。7)
躯幹部体脂肪率(%)
の変化量(投与開始時〜24週後)
Mean±SD(例数)
95%信頼区間
0.24±2.07(31)
0.52 〜 0.99
0.006 mg投与群
3.03±2.51(31)*
3.95 〜 2.11
0.012 mg投与群
4.58±2.59(32)*
5.51 〜3.64
プラセボ投与群
血清IGF-Ⅰ SDスコア
開始時
変化量(投与開始時〜24週後)
Mean±SD(例数) Mean±SD(例数)
プラセボ投与群
95%信頼区間
2.760±1.407(31)0.131±0.545(31) 0.331 〜 0.069
0.006 mg投与群 2.977±1.771(31)1.971±1.270(31)
*
1.505 〜 2.437
0.012 mg投与群 3.096±1.972(32)3.633±1.667(32)
*
3.032 〜 4.233
* p値
群内比較:投与開始時 vs 24週後(p<0.001)
②長期投与試験
二重盲検試験において12週間以上の治験薬の投与を行い、12
週以降の躯幹部体脂肪のデータが存在している成人成長ホル
モン分泌不全症患者を対象に長期投与試験を行った。8)
試 験 薬:グロウジェクト注射用8mg(n=12)
対 照 薬:グロウジェクト注射用1.33mg(n=12)
Mean±SD
躯幹部体脂肪率(%)の変化量(長期投与試験 開始時〜48週後)
50.0
プラセボ/本剤
本剤/本剤
0.0
608.7±127.3
Mean±SD
【薬物動態】
**
健常成人男子にグロウジェクト注射用8mgとグロウジェク
ト 注 射 用1.33mgを用い、皮下注射
(各々2.8mgを1回投与)
における生物学的同等性試験を実施した。その結果、本剤
とグロウジェクト注射用1.33mgは生物学的に同等であっ
た。4)
100.0
Tmax
(hr)
Mean±SD(例数)
95%信頼区間
4.01±3.21(29)**
5.24 〜 2.79
0.35±3.02(59)
0.44 〜 1.13
血清IGF-Ⅰ SDスコア
0
4
8
12
16
長期投与試験 開始時 変化量(長期投与試験 開始時〜48週後)
20
24
時 間( h r )
- 94
Mean±SD(例数)Mean±SD(例数)
95%信頼区間
プラセボ/本剤
2.849±1.602(29)3.102±1.887(29)**
2.384 〜 3.819
本剤/本剤
0.102±2.174(58)0.223±1.873(59) 0.711 〜 0.266
** p値
群内比較:長期投与試験 開始時 vs 48週後(p<0.001)
1)調製方法
(1)プランジャーロッドを添付溶解液の針付き注射器型容器
にねじ込み取り付ける。
(2)針付き注射器型容器のニードルシールド(針カバー)をは
ずし、バイアルに溶解液をゆっくり加えた後、静かに円
を描くように回して溶解すること(激しく振とうしないこ
と)。
(3)添付溶解液は、残さず全量をバイアルに注入すること。
(4)添付溶解液の針付き注射器型容器の針先には十分注意し、
注射には使用しないこと。
(5)完全に溶けなかった場合、又は浮遊物が見られた場合は
使用しないこと。
2)溶解後の保存方法
溶解後は2〜8℃で遮光保存し、42日以内に使用すること(溶
解後凍結した場合は使用しないこと)。
3)筋肉内注射時
筋肉内注射する場合には、組織・神経等への影響を避ける
ため、下記の点に注意すること。
(1)同一部位への反復注射は行わないこと。
(2)神経走行部位を避けること。
(3)注射針を刺入したとき、激痛を訴えたり血液の逆流をみ
た場合は直ちに針を抜き、部位をかえて注射すること。
(4)注射部位に疼痛、硬結をみることがある。
4)皮下注射時
皮下注射する場合には、注射部位を上腕、大腿、腹部、臀
部等広範に求め、順序よく移動し、同一部位に短期間内に
繰返し注射しないこと。
10.その他の注意
1)
ヒト成長ホルモンと白血病の因果関係は明らかではないが、
ヒト成長ホルモンの投与を受けた患者に白血病があらわれ
たとの報告があるので、定期的に血液検査を行うなど、患
者の状態を十分に観察すること。白血病、悪性腫瘍を発生
しやすい先天異常、免疫不全症候群等の基礎疾患のある患
者、脳腫瘍などによる放射線治療歴のある患者、抗がん薬
や免疫抑制薬の投与歴のある患者、治療開始時の血液像に
異常がある患者に投与する場合には、特に患者の状態を観
察すること。
ヒト成長ホルモンの投与を受けた患者に脳腫瘍が再発した
2)
との報告がある。
3)
小児がんの既往を有する患者にヒト成長ホルモンを投与し
た場合、二次性腫瘍の発現リスクが上昇するとの報告がある。
4)
成人成長ホルモン分泌不全症患者に本剤と本剤以外のホル
モン剤を併用する場合には、併用するホルモン剤が血清IGF-Ⅰ
濃度に影響を及ぼすことがあるため、慎重に血清IGF-Ⅰ濃度
をモニタリングすること。
5)
連続投与した場合、ヒト成長ホルモンに対する抗体が生じ
ることがある。抗体の産生により効果の減弱がみられる場
合には、投与を中止し、適宜他の治療法を考慮すること。
動物実験で妊娠前、妊娠初期投与試験において、高投与量
6)
群で交尾率及び妊娠率の低下が報告されている。3)
A U C0-24h
Cmax
M R T 0-24h
(ng・hr/mL) (ng/mL) (hr)
グロウジェクト
注射用8mg
グロウジェクト
注射用1.33mg
血清中hGH濃度(ng/mL)
83.7±20.9
3.7±1.4
3.7±1.3
644.7±114.8
72.7±19.8
3.5±0.7
4.9±1.4
【臨床成績】
**
1.臨床効果
1)
成長ホルモン分泌不全性低身長症
グロウジェクト注射用8mgの臨床試験(0.175mg/kg/週)
におい
て、6ヵ月間治療した45例(新規例28例、切替例17例)
における
年間成長速度を下表に示した。5)
成長速度
(cm/年)
投与開始時
新規例
切替例
4.7±1.0
5.2±1.4
8.7±2.7
(p<0.001)
7.0±1.6
(p<0.01)
6.7±1.4
(p<0.01)
切替時
投与6ヵ月後
Mean±SD
2)ターナー症候群における低身長
グロウジェクト注射用1.33mgのターナー症候群を対象とし
た臨床試験(0.35mg/kg/週)において24 月間治療した39
例における年間成長速度を下表に示した。6)
成長速度(cm/年)
投与開始時
投与
4.1±1.5
12ヵ月後
7.2±1.5
(p<0.001)
24ヵ月後
5.3±1.1
(p<0.001)
Mean±SD
3)
成人成長ホルモン分泌不全症
グロウジェクトBC注射用8mgの成人成長ホルモン分泌不全症を
対象とした臨床試験(二重盲検試験、長期投与試験)におけ
る主な成績を下表に示した。投与量及び投与方法は0.003 mg/
kg/日〜0.012 mg/kg/日を1日1回就寝前に皮下投与した。
①二重盲検試験
成人成長ホルモン分泌不全症と診断され、GH分泌刺激試験
において、GH頂値が3 ng/mL(リコンビナント標準品を用い
た場合は1.8 ng/mL)未満の患者を対象にプラセボを対照と
した二重盲検試験を行った。なお、用法・用量に関する検討
を行うため、0.012 mg/kg/日まで漸増する群と、維持用量
0.006 mg/kg/日まで漸増する群を設定した。7)
躯幹部体脂肪率(%)
の変化量(投与開始時〜24週後)
Mean±SD(例数)
95%信頼区間
0.24±2.07(31)
0.52 〜 0.99
0.006 mg投与群
3.03±2.51(31)*
3.95 〜 2.11
0.012 mg投与群
4.58±2.59(32)*
5.51 〜3.64
プラセボ投与群
血清IGF-Ⅰ SDスコア
開始時
変化量(投与開始時〜24週後)
Mean±SD(例数) Mean±SD(例数)
プラセボ投与群
95%信頼区間
2.760±1.407(31)0.131±0.545(31) 0.331 〜 0.069
0.006 mg投与群 2.977±1.771(31)1.971±1.270(31)
*
1.505 〜 2.437
0.012 mg投与群 3.096±1.972(32)3.633±1.667(32)
*
3.032 〜 4.233
* p値
群内比較:投与開始時 vs 24週後(p<0.001)
②長期投与試験
二重盲検試験において12週間以上の治験薬の投与を行い、12
週以降の躯幹部体脂肪のデータが存在している成人成長ホル
モン分泌不全症患者を対象に長期投与試験を行った。8)
試 験 薬:グロウジェクト注射用8mg(n=12)
対 照 薬:グロウジェクト注射用1.33mg(n=12)
Mean±SD
躯幹部体脂肪率(%)の変化量(長期投与試験 開始時〜48週後)
50.0
プラセボ/本剤
本剤/本剤
0.0
608.7±127.3
Mean±SD
【薬物動態】
**
健常成人男子にグロウジェクト注射用8mgとグロウジェク
ト 注 射 用1.33mgを用い、皮下注射
(各々2.8mgを1回投与)
における生物学的同等性試験を実施した。その結果、本剤
とグロウジェクト注射用1.33mgは生物学的に同等であっ
た。4)
100.0
Tmax
(hr)
Mean±SD(例数)
95%信頼区間
4.01±3.21(29)**
5.24 〜 2.79
0.35±3.02(59)
0.44 〜 1.13
血清IGF-Ⅰ SDスコア
0
4
8
12
16
長期投与試験 開始時 変化量(長期投与試験 開始時〜48週後)
20
24
時 間( h r )
- 94
Mean±SD(例数)Mean±SD(例数)
95%信頼区間
プラセボ/本剤
2.849±1.602(29)3.102±1.887(29)**
2.384 〜 3.819
本剤/本剤
0.102±2.174(58)0.223±1.873(59) 0.711 〜 0.266
** p値
群内比較:長期投与試験 開始時 vs 48週後(p<0.001)