よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ヒューマトロープ注射用6mg
ヒューマトロープ注射用12mg(2)
(4)本剤の投与により浮腫、関節痛等があらわれることがあるた
め、観察を十分に行い、異常が認められた場合は投与量の減量
あるいは投与中止を考慮すること。
内分泌専門医もしくはその指導の下で行うこと。
(5)本剤の治療は、
2)頭蓋内器質性疾患の合併ないし既往歴、治療歴又は周産期
異常の既往があり、成長ホルモンを含む複数の下垂体ホル
モンの分泌低下がある患者では、1種類の成長ホルモン分泌
刺激試験における血清(血漿)成長ホルモン濃度の頂値が重
症の基準を満たすもの。
(2)成人期発症型では、頭蓋内器質性疾患の合併ないし既往歴、
治療歴又は周産期異常の既往がある患者のうち、以下のい
ずれかを満たすもの。
1)成長ホルモンを含む複数の下垂体ホルモンの分泌低下があ
る患者で、1種類の成長ホルモン分泌刺激試験における血清
(血漿)
成長ホルモン濃度の頂値が重症の基準を満たすもの。
2)成長ホルモン単独の分泌低下がある患者で、2種類の成長ホ
ルモン分泌刺激試験における血清(血漿)成長ホルモン濃度
の頂値が重症の基準を満たすもの。
3 .相互作用
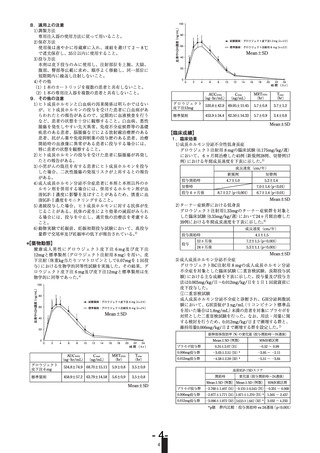
併用注意(併用に注意すること)
[成長ホルモン分泌刺激試験の種類と成人成長ホルモン分泌不全
症で重症と診断される血清(血漿)成長ホルモン濃度の頂値]
成長ホルモン分泌刺激試験の
種類
GHRP-2
機序
糖質コルチコイドが成長抑
制効果を有するため。
成長ホルモンが11β-ヒドロ
キシステロイドデヒドロゲ
ナーゼ1型
(11β-HSD-1)
を
抑制することにより、コル
チゾンからコルチゾールへ
の変換を減少させるため。
インスリン
成長ホルモンが抗インスリ
ン様作用を有するため。
本剤がCYP3Aを誘導するた
め。
インスリンの血糖降下作用
が減弱することがある。
主にCYP3Aで代 これらの薬剤の血中濃度が
謝される薬剤
低下し、作用が減弱するこ
性ホルモン製剤 とがある。
シクロスポリン
抗てんかん剤等
経口エストロゲン 成長ホルモンの作用が抑制
されることがある。成人成
長ホルモン分泌不全症(重
症に限る)の患者では本剤
の増量を検討すること。
重症と診断される血清(血漿)
成長ホルモン濃度の頂値
インスリン、
アルギニン、
グルカゴン
薬剤名等
臨床症状・措置方法
糖質コルチコイド 成長ホルモンの成長促進作
用が抑制されることがある。
血清コルチゾール濃度が低
下することがあるので、糖
質コルチコイドの用量に注
意すること。
1.8ng/mL以下
9ng/mL以下
<用法・用量に関連する使用上の注意>
◇成人成長ホルモン分泌不全症
(1)本剤の投与量は、血清IGF-I濃度を参照して調整すること。
血清IGF-I濃度は投与開始後24週目までは4週間に1回、そ
れ以降は12週から24週間に1回の測定を目安とすること。ま
た、副作用の発現等の際は、適宜、血清IGF-I濃度を測定し、
本剤の減量、投与中止等適切な処置をとること。
エストロゲンが IGF-I産生
を抑制するため。
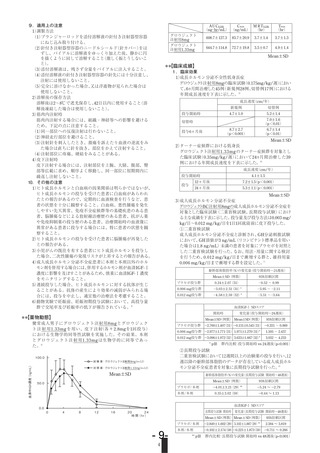
4 .副作用
◇成長ホルモン分泌不全性低身長症注)
承認時における安全性評価対象例175例中12例(6.9%)に注
射部疼痛(6例)等の副作用が認められた。また、使用成績調
査(再審査終了時)における安全性評価対象例1590例中85例
(5.3%)
に臨床検査値の異常変動を含む副作用が認められ、主
な副作用は注射部疼痛(9件:0.6%)
、肝機能障害(5件:0.3%)
、
関節痛
(5件:0.3%)
、
T3値の増加
(5件:0.3%)
等であった。
◇ターナー症候群における低身長注)
承認時における安全性評価対象例163例中9例(5.5%)に関
節痛(2例)等の副作用が認められた。また、使用成績調査(再
審査終了時)における安全性評価対象例86例中8例(9.3%)
に臨床検査値の異常変動を含む副作用が認められ、主な副作
用は高血糖(2件:2.3%)、耐糖能異常(2件:2.3%)、血清ALT
(GPT)上昇(2件:2.3%)等であった。
◇軟骨異栄養症(軟骨無形成症・軟骨低形成症)における低身
長
承認時における安全性評価対象例46例中25例(54.3%)に臨
床検査値の異常変動を含む副作用が認められた。主な副作用
は、
O脚の増悪
(2件:4.3%)
、
OGTT異常
(10件:21.7%)
、
好酸球
増多(6件:13.0%)
、HbA1上昇(6件:13.0%)であった。
また、使
用成績調査(再審査終了時)における安全性評価対象例103例
中17例(16.5%)に臨床検査値の異常変動を含む副作用が認
められ、主な副作用は異型リンパ球増加(3件:2.9%)
、脊柱管
狭窄症
(3件:2.9%)
、
CK
(CPK)
上昇
(2件:1.9%)
であった。
◇成人成長ホルモン分泌不全症
承認時における安全性評価対象例61例中36例(59.0%)に臨
床検査値の異常変動を含む副作用が認められた。主な副作用
は関節痛(12件:19.7%)、浮腫(7件:11.5%)であった。また、
特定使用成績調査(再審査終了時)における安全性評価対象
例402例中52例(12.9%)に臨床検査値の異常変動を含む副
作用が認められた。主な副作用は、関節痛(6件:1.5%)、糖尿
病(5件:1.2%)、末梢性浮腫(4件:1.0%)であった。
(2)加齢に伴い生理的な成長ホルモンの分泌量や血清IGF-I濃度
が低下することが知られている。
本剤投与による症状の改善が
認められなくなり、かつ本剤を投与しなくても血清IGF-I濃度が
基準範囲内にある場合は、
投与中止を考慮すること。
【使用上の注意】※※
1 .慎重投与(次の患者には慎重に投与すること)
(頭蓋咽頭腫、下垂体腺腫、松果体腫等)
による成長ホルモ
(1)脳腫瘍
ン分泌不全性低身長症又は成人成長ホルモン分泌不全症の患者
[成長ホルモンが細胞増殖作用を有するため、基礎疾患の進行
や再発の観察を十分に行い慎重に投与すること。]
(2)心疾患・腎疾患のある患者
[ときに一過性の浮腫があらわれることがあるので、特に心疾
患、腎疾患のある患者に投与する場合には、観察を十分に行い
慎重に投与すること。]
(3)脊椎管狭窄・大孔狭窄のある軟骨異栄養症(軟骨無形成症・軟骨
低形成症)の患者
[本剤により症状の悪化を助長する可能性があるので、低身長
改善の有益性が脊椎管狭窄・大孔狭窄悪化の危険性を上回ると
判断される場合のみ投与を考慮すること。
MRI等による定期的
観察を十分行い、脊椎管狭窄・大孔狭窄の悪化がみられた場合
には本剤の投与を中止すること。]
2 .重要な基本的注意
◇成人成長ホルモン分泌不全症
(1)成人成長ホルモン分泌不全症患者では脳腫瘍の既往のある患
者が多く含まれており、国内臨床試験において脳腫瘍の再発が
報告されているため、脳腫瘍の既往のある患者に本剤を投与す
る場合は定期的に画像診断を実施し、脳腫瘍の発現や再発の有
無を注意深く観察すること。
(2)本剤の投与中は、血清IGF-I濃度が基準範囲上限を超えない
よう、定期的に検査を実施すること。検査頻度については、
「用
法・用量に関連する使用上の注意」の項を参照すること。
(3)本剤の投与により血糖値、HbA1cの上昇があらわれることが
あるため、定期的に血糖値、HbA1cあるいは尿糖等を測定し、
異常が認められた場合は投与量の減量あるいは投与中止を考
慮すること。
(1)重大な副作用注)
:O脚を合併した軟骨異栄養症(軟骨無形
1)O脚の悪化(頻度不明)
成症・軟骨低形成症)患者に本剤を投与したところ、O脚が悪化
し、手術を受けた症例が報告されている。このような患者に本
剤を投与する場合には、観察を十分に行うこと。異常が認めら
れた場合には投与を中止し、適切な処置を行うこと。
2)けいれん(頻度不明)
:けいれんがあらわれることがあるので、
このような症状があらわれた場合には投与を中止するなど、適
切な処置を行うこと。
- 35(2)
ヒューマトロープ注射用12mg(2)
(4)本剤の投与により浮腫、関節痛等があらわれることがあるた
め、観察を十分に行い、異常が認められた場合は投与量の減量
あるいは投与中止を考慮すること。
内分泌専門医もしくはその指導の下で行うこと。
(5)本剤の治療は、
2)頭蓋内器質性疾患の合併ないし既往歴、治療歴又は周産期
異常の既往があり、成長ホルモンを含む複数の下垂体ホル
モンの分泌低下がある患者では、1種類の成長ホルモン分泌
刺激試験における血清(血漿)成長ホルモン濃度の頂値が重
症の基準を満たすもの。
(2)成人期発症型では、頭蓋内器質性疾患の合併ないし既往歴、
治療歴又は周産期異常の既往がある患者のうち、以下のい
ずれかを満たすもの。
1)成長ホルモンを含む複数の下垂体ホルモンの分泌低下があ
る患者で、1種類の成長ホルモン分泌刺激試験における血清
(血漿)
成長ホルモン濃度の頂値が重症の基準を満たすもの。
2)成長ホルモン単独の分泌低下がある患者で、2種類の成長ホ
ルモン分泌刺激試験における血清(血漿)成長ホルモン濃度
の頂値が重症の基準を満たすもの。
3 .相互作用
併用注意(併用に注意すること)
[成長ホルモン分泌刺激試験の種類と成人成長ホルモン分泌不全
症で重症と診断される血清(血漿)成長ホルモン濃度の頂値]
成長ホルモン分泌刺激試験の
種類
GHRP-2
機序
糖質コルチコイドが成長抑
制効果を有するため。
成長ホルモンが11β-ヒドロ
キシステロイドデヒドロゲ
ナーゼ1型
(11β-HSD-1)
を
抑制することにより、コル
チゾンからコルチゾールへ
の変換を減少させるため。
インスリン
成長ホルモンが抗インスリ
ン様作用を有するため。
本剤がCYP3Aを誘導するた
め。
インスリンの血糖降下作用
が減弱することがある。
主にCYP3Aで代 これらの薬剤の血中濃度が
謝される薬剤
低下し、作用が減弱するこ
性ホルモン製剤 とがある。
シクロスポリン
抗てんかん剤等
経口エストロゲン 成長ホルモンの作用が抑制
されることがある。成人成
長ホルモン分泌不全症(重
症に限る)の患者では本剤
の増量を検討すること。
重症と診断される血清(血漿)
成長ホルモン濃度の頂値
インスリン、
アルギニン、
グルカゴン
薬剤名等
臨床症状・措置方法
糖質コルチコイド 成長ホルモンの成長促進作
用が抑制されることがある。
血清コルチゾール濃度が低
下することがあるので、糖
質コルチコイドの用量に注
意すること。
1.8ng/mL以下
9ng/mL以下
<用法・用量に関連する使用上の注意>
◇成人成長ホルモン分泌不全症
(1)本剤の投与量は、血清IGF-I濃度を参照して調整すること。
血清IGF-I濃度は投与開始後24週目までは4週間に1回、そ
れ以降は12週から24週間に1回の測定を目安とすること。ま
た、副作用の発現等の際は、適宜、血清IGF-I濃度を測定し、
本剤の減量、投与中止等適切な処置をとること。
エストロゲンが IGF-I産生
を抑制するため。
4 .副作用
◇成長ホルモン分泌不全性低身長症注)
承認時における安全性評価対象例175例中12例(6.9%)に注
射部疼痛(6例)等の副作用が認められた。また、使用成績調
査(再審査終了時)における安全性評価対象例1590例中85例
(5.3%)
に臨床検査値の異常変動を含む副作用が認められ、主
な副作用は注射部疼痛(9件:0.6%)
、肝機能障害(5件:0.3%)
、
関節痛
(5件:0.3%)
、
T3値の増加
(5件:0.3%)
等であった。
◇ターナー症候群における低身長注)
承認時における安全性評価対象例163例中9例(5.5%)に関
節痛(2例)等の副作用が認められた。また、使用成績調査(再
審査終了時)における安全性評価対象例86例中8例(9.3%)
に臨床検査値の異常変動を含む副作用が認められ、主な副作
用は高血糖(2件:2.3%)、耐糖能異常(2件:2.3%)、血清ALT
(GPT)上昇(2件:2.3%)等であった。
◇軟骨異栄養症(軟骨無形成症・軟骨低形成症)における低身
長
承認時における安全性評価対象例46例中25例(54.3%)に臨
床検査値の異常変動を含む副作用が認められた。主な副作用
は、
O脚の増悪
(2件:4.3%)
、
OGTT異常
(10件:21.7%)
、
好酸球
増多(6件:13.0%)
、HbA1上昇(6件:13.0%)であった。
また、使
用成績調査(再審査終了時)における安全性評価対象例103例
中17例(16.5%)に臨床検査値の異常変動を含む副作用が認
められ、主な副作用は異型リンパ球増加(3件:2.9%)
、脊柱管
狭窄症
(3件:2.9%)
、
CK
(CPK)
上昇
(2件:1.9%)
であった。
◇成人成長ホルモン分泌不全症
承認時における安全性評価対象例61例中36例(59.0%)に臨
床検査値の異常変動を含む副作用が認められた。主な副作用
は関節痛(12件:19.7%)、浮腫(7件:11.5%)であった。また、
特定使用成績調査(再審査終了時)における安全性評価対象
例402例中52例(12.9%)に臨床検査値の異常変動を含む副
作用が認められた。主な副作用は、関節痛(6件:1.5%)、糖尿
病(5件:1.2%)、末梢性浮腫(4件:1.0%)であった。
(2)加齢に伴い生理的な成長ホルモンの分泌量や血清IGF-I濃度
が低下することが知られている。
本剤投与による症状の改善が
認められなくなり、かつ本剤を投与しなくても血清IGF-I濃度が
基準範囲内にある場合は、
投与中止を考慮すること。
【使用上の注意】※※
1 .慎重投与(次の患者には慎重に投与すること)
(頭蓋咽頭腫、下垂体腺腫、松果体腫等)
による成長ホルモ
(1)脳腫瘍
ン分泌不全性低身長症又は成人成長ホルモン分泌不全症の患者
[成長ホルモンが細胞増殖作用を有するため、基礎疾患の進行
や再発の観察を十分に行い慎重に投与すること。]
(2)心疾患・腎疾患のある患者
[ときに一過性の浮腫があらわれることがあるので、特に心疾
患、腎疾患のある患者に投与する場合には、観察を十分に行い
慎重に投与すること。]
(3)脊椎管狭窄・大孔狭窄のある軟骨異栄養症(軟骨無形成症・軟骨
低形成症)の患者
[本剤により症状の悪化を助長する可能性があるので、低身長
改善の有益性が脊椎管狭窄・大孔狭窄悪化の危険性を上回ると
判断される場合のみ投与を考慮すること。
MRI等による定期的
観察を十分行い、脊椎管狭窄・大孔狭窄の悪化がみられた場合
には本剤の投与を中止すること。]
2 .重要な基本的注意
◇成人成長ホルモン分泌不全症
(1)成人成長ホルモン分泌不全症患者では脳腫瘍の既往のある患
者が多く含まれており、国内臨床試験において脳腫瘍の再発が
報告されているため、脳腫瘍の既往のある患者に本剤を投与す
る場合は定期的に画像診断を実施し、脳腫瘍の発現や再発の有
無を注意深く観察すること。
(2)本剤の投与中は、血清IGF-I濃度が基準範囲上限を超えない
よう、定期的に検査を実施すること。検査頻度については、
「用
法・用量に関連する使用上の注意」の項を参照すること。
(3)本剤の投与により血糖値、HbA1cの上昇があらわれることが
あるため、定期的に血糖値、HbA1cあるいは尿糖等を測定し、
異常が認められた場合は投与量の減量あるいは投与中止を考
慮すること。
(1)重大な副作用注)
:O脚を合併した軟骨異栄養症(軟骨無形
1)O脚の悪化(頻度不明)
成症・軟骨低形成症)患者に本剤を投与したところ、O脚が悪化
し、手術を受けた症例が報告されている。このような患者に本
剤を投与する場合には、観察を十分に行うこと。異常が認めら
れた場合には投与を中止し、適切な処置を行うこと。
2)けいれん(頻度不明)
:けいれんがあらわれることがあるので、
このような症状があらわれた場合には投与を中止するなど、適
切な処置を行うこと。
- 35(2)