よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
〈成人成長ホルモン分泌不全症(重症に限る)〉
5%以上
過敏症
5%未満
湿疹、発疹
内分泌
甲状腺機能低下症a)
耐糖能低下b)、月経困難
筋・骨格系
関節痛、筋脱力、筋痛、
四肢のこわばり
腱炎、腱障害、腱鞘炎、
関節炎、肩関節の違和感、
踵骨棘、四肢痛、胸骨痛
代謝異常
ALPの上昇
血清ナトリウム低下、血
清クロール低下、リン脂
質上昇、血清無機リン上
昇、LDL-コレステロー
ル上昇、血清カルシウム
上昇、トリグリセライド
上昇
泌尿器
尿潜血・顕微鏡的血尿
蛋白尿
肝・胆道系
ASTの上昇、ALTの上
昇、γ-GTP上昇
胆のうポリープ
消化器
精神神経系
嘔気、嘔吐、腹痛、消化
不良、便秘
頭痛、不安、うつ状態、
感情不安定、無気力・集
中力低下、知覚減退、疎
外感
血液
食欲亢進、傾眠、不眠、
めまい
異常感覚
貧血、白血球数上昇、白
血球異常、好酸球上昇
循環器
血圧上昇、不整脈
投与部位
出血
熱感
全身症状
浮腫
背部痛、熱感、疲労、倦
怠感、顔面浮腫
その他
15. その他の注意
15.1 臨床使用に基づく情報
〈効能共通〉
15.1.1 ヒト成長ホルモンと白血病の因果関係は明らかではな
いが、ヒト成長ホルモンの投与を受けた患者に白血病があら
われたとの報告があるので、定期的に血液検査を行うなど、
患者の状態を十分に観察すること。白血病、悪性腫瘍を発生
しやすい先天異常、免疫不全症候群等の基礎疾患のある患者、
脳腫瘍などによる放射線治療歴のある患者、抗がん薬や免疫
抑制薬の投与歴のある患者、治療開始時の血液像に異常があ
る患者に投与する場合には、特に患者の状態を観察すること。
15.1.2 ヒト成長ホルモンの投与を受けた患者に脳腫瘍が再発
したとの報告がある。
15.1.3 小児がんの既往を有する患者にヒト成長ホルモンを投
与した場合、二次性腫瘍の発現リスクが上昇するとの報告が
ある。
15.1.4 連続投与した場合、ヒト成長ホルモンに対する抗体が
生じることがある。抗体の産生により効果の減弱がみられる
場合には、投与を中止し、適宜他の治療法を考慮すること。
15.1.5 外国において、溶解液(m -クレゾール含有)に関連し
た筋炎があらわれたとの報告がある。[3.1参照]
〈骨端線閉鎖を伴わない慢性腎不全における低身長〉
15.1.6 成長ホルモン分泌不全症の患者と比較して、ヒト成長ホル
モン投与による頭蓋内圧亢進の発現頻度が高いとの報告がある。
[11.2参照]
15.2 非臨床試験に基づく情報
15.2.1 動物実験で妊娠前、妊娠初期投与試験において、高投
与量群で交尾率及び妊娠率の低下が報告されている。
頻度不明
難聴、喀血、喘息、単純
疱疹、脱毛、真菌性皮膚
炎、多汗、ガングリオン、
白内障、眼痛、飛蚊症、
眼の乾燥、不正咬合、歯
周炎、体重増加、副鼻腔
炎、顔面痛
16. 薬物動態
16.1 血中濃度
a)[8.2参照]
b)[8.1参照]
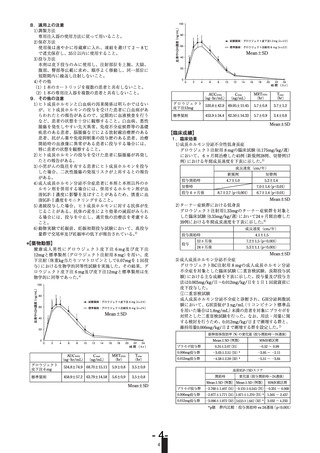
16.1.1 単回投与
アジア人健常成人男子(20例)に12mg製剤を単回皮下注射(ソマトロ
13. 過量投与
過量投与により最初は血糖低下が、次いで血糖上昇が認めら
れることがある。長期の過量投与により先端巨大症の症状が
認められることがある。
ピンとして5.3mg)したところ、投与後の成長ホルモン血清中濃度の
Cmaxは153±58mIU/L、AUC0-∞ は1420±300mIU・hr/L、tmaxは4.85±
2.11hr、t1/2は3.64±2.41hr(平均値±標準偏差)であり、また5.3mg
製剤の単回皮下注射(ソマトロピンとして5.3mg)後も各パラメーター
は同様の値を示し、両製剤は生物学的に同等であることが確認され
14. 適用上の注意
14.1 薬剤調製時の注意
本剤を使用する際には、必ず添付の取扱説明書を読むこと。
14.2 薬剤投与時の注意
14.2.1 筋肉内注射時
筋肉内注射する場合には、組織・神経等への影響を避けるた
め、下記の点に注意すること。
・同一部位への反復注射は行わないこと。
・神経走行部位を避けること。
・注射針を刺入したとき、激痛を訴えたり血液の逆流をみた
場合は直ちに針を抜き、部位を変えて注射すること。
・注射部位に疼痛、硬結をみることがある。
14.2.2 皮下注射時
皮下注射する場合には、注射部位を上腕、大腿、腹部、臀部等
広範に求め、順序よく移動し、同一部位に短期間内に繰り返し
注射しないこと。
14.2.3 その他
本剤はJIS T 3226-2に適合するA形(型)専用注射針を使用
すること。
14.3 薬剤交付時の注意
14.3.1 保存時
溶解後は、凍結を避け2~8℃で遮光保存し、4週間以内に使
用すること。(溶解後凍結した場合は使用しないこと。)
14.3.2 その他
感染症の原因となるおそれがあるので、1本の本剤を複数の
患者に使用しないこと。
た1)。
16.1.2 反復投与
欧米人のデータでは、6カ月間反復皮下注射後も蓄積性が認められな
いとの報告がある2)。
16.2 吸収
皮下注射と筋肉内注射(各々8国際単位(2.8mgに相当)1回投与)時
の血中動態を1.33mg製剤を用いて交叉試験法により比較した試験で
は、両投与経路間のバイオアベイラビリティーは同等であることが確
認されている3)。
16.6 特定の背景を有する患者
慢性腎不全の小児に皮下注射し血中濃度の推移を検討したところ、投
与24時間後には投与前と同程度の濃度を示した4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
〈骨端線閉鎖を伴わない成長ホルモン分泌不全性低身長症〉
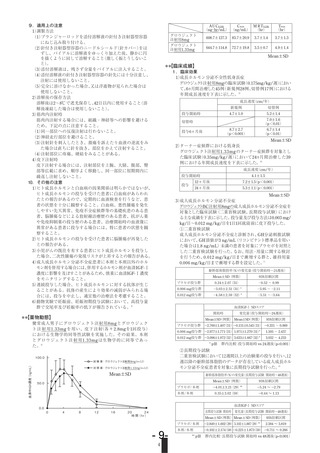
17.1.1 国内臨床試験(筋肉内注射)
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を2~3回に分
割して筋肉内注射したとき、ヒト成長ホルモン製剤による前治療歴の
ない16例における1年後の身長の伸びは、無治療時の平均3.5±1.5cm/
年に対して平均7.7±1.8cm/年であり、下垂体抽出ヒト成長ホルモン
製剤による前治療歴のある9例における1年後の身長の伸びは、無治療
時の平均3.3±1.2cm/年に対して平均5.8cm±1.0cm/年であった5)。
副作用は25例中悪心の1例のみであった。
抗ヒト成長ホルモン抗体の発現は、前治療歴のない16例のうち2例に
認められ、前治療歴のある9例では抗体の発現は認められなかった。
17.1.2 国内臨床試験(連日皮下注射)
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を6~7回に
分割して連日皮下注射したとき、ヒト成長ホルモン製剤による前治療
歴のない20例における1年後の身長の伸びは、無治療時の平均3.0±
- 254
5%以上
過敏症
5%未満
湿疹、発疹
内分泌
甲状腺機能低下症a)
耐糖能低下b)、月経困難
筋・骨格系
関節痛、筋脱力、筋痛、
四肢のこわばり
腱炎、腱障害、腱鞘炎、
関節炎、肩関節の違和感、
踵骨棘、四肢痛、胸骨痛
代謝異常
ALPの上昇
血清ナトリウム低下、血
清クロール低下、リン脂
質上昇、血清無機リン上
昇、LDL-コレステロー
ル上昇、血清カルシウム
上昇、トリグリセライド
上昇
泌尿器
尿潜血・顕微鏡的血尿
蛋白尿
肝・胆道系
ASTの上昇、ALTの上
昇、γ-GTP上昇
胆のうポリープ
消化器
精神神経系
嘔気、嘔吐、腹痛、消化
不良、便秘
頭痛、不安、うつ状態、
感情不安定、無気力・集
中力低下、知覚減退、疎
外感
血液
食欲亢進、傾眠、不眠、
めまい
異常感覚
貧血、白血球数上昇、白
血球異常、好酸球上昇
循環器
血圧上昇、不整脈
投与部位
出血
熱感
全身症状
浮腫
背部痛、熱感、疲労、倦
怠感、顔面浮腫
その他
15. その他の注意
15.1 臨床使用に基づく情報
〈効能共通〉
15.1.1 ヒト成長ホルモンと白血病の因果関係は明らかではな
いが、ヒト成長ホルモンの投与を受けた患者に白血病があら
われたとの報告があるので、定期的に血液検査を行うなど、
患者の状態を十分に観察すること。白血病、悪性腫瘍を発生
しやすい先天異常、免疫不全症候群等の基礎疾患のある患者、
脳腫瘍などによる放射線治療歴のある患者、抗がん薬や免疫
抑制薬の投与歴のある患者、治療開始時の血液像に異常があ
る患者に投与する場合には、特に患者の状態を観察すること。
15.1.2 ヒト成長ホルモンの投与を受けた患者に脳腫瘍が再発
したとの報告がある。
15.1.3 小児がんの既往を有する患者にヒト成長ホルモンを投
与した場合、二次性腫瘍の発現リスクが上昇するとの報告が
ある。
15.1.4 連続投与した場合、ヒト成長ホルモンに対する抗体が
生じることがある。抗体の産生により効果の減弱がみられる
場合には、投与を中止し、適宜他の治療法を考慮すること。
15.1.5 外国において、溶解液(m -クレゾール含有)に関連し
た筋炎があらわれたとの報告がある。[3.1参照]
〈骨端線閉鎖を伴わない慢性腎不全における低身長〉
15.1.6 成長ホルモン分泌不全症の患者と比較して、ヒト成長ホル
モン投与による頭蓋内圧亢進の発現頻度が高いとの報告がある。
[11.2参照]
15.2 非臨床試験に基づく情報
15.2.1 動物実験で妊娠前、妊娠初期投与試験において、高投
与量群で交尾率及び妊娠率の低下が報告されている。
頻度不明
難聴、喀血、喘息、単純
疱疹、脱毛、真菌性皮膚
炎、多汗、ガングリオン、
白内障、眼痛、飛蚊症、
眼の乾燥、不正咬合、歯
周炎、体重増加、副鼻腔
炎、顔面痛
16. 薬物動態
16.1 血中濃度
a)[8.2参照]
b)[8.1参照]
16.1.1 単回投与
アジア人健常成人男子(20例)に12mg製剤を単回皮下注射(ソマトロ
13. 過量投与
過量投与により最初は血糖低下が、次いで血糖上昇が認めら
れることがある。長期の過量投与により先端巨大症の症状が
認められることがある。
ピンとして5.3mg)したところ、投与後の成長ホルモン血清中濃度の
Cmaxは153±58mIU/L、AUC0-∞ は1420±300mIU・hr/L、tmaxは4.85±
2.11hr、t1/2は3.64±2.41hr(平均値±標準偏差)であり、また5.3mg
製剤の単回皮下注射(ソマトロピンとして5.3mg)後も各パラメーター
は同様の値を示し、両製剤は生物学的に同等であることが確認され
14. 適用上の注意
14.1 薬剤調製時の注意
本剤を使用する際には、必ず添付の取扱説明書を読むこと。
14.2 薬剤投与時の注意
14.2.1 筋肉内注射時
筋肉内注射する場合には、組織・神経等への影響を避けるた
め、下記の点に注意すること。
・同一部位への反復注射は行わないこと。
・神経走行部位を避けること。
・注射針を刺入したとき、激痛を訴えたり血液の逆流をみた
場合は直ちに針を抜き、部位を変えて注射すること。
・注射部位に疼痛、硬結をみることがある。
14.2.2 皮下注射時
皮下注射する場合には、注射部位を上腕、大腿、腹部、臀部等
広範に求め、順序よく移動し、同一部位に短期間内に繰り返し
注射しないこと。
14.2.3 その他
本剤はJIS T 3226-2に適合するA形(型)専用注射針を使用
すること。
14.3 薬剤交付時の注意
14.3.1 保存時
溶解後は、凍結を避け2~8℃で遮光保存し、4週間以内に使
用すること。(溶解後凍結した場合は使用しないこと。)
14.3.2 その他
感染症の原因となるおそれがあるので、1本の本剤を複数の
患者に使用しないこと。
た1)。
16.1.2 反復投与
欧米人のデータでは、6カ月間反復皮下注射後も蓄積性が認められな
いとの報告がある2)。
16.2 吸収
皮下注射と筋肉内注射(各々8国際単位(2.8mgに相当)1回投与)時
の血中動態を1.33mg製剤を用いて交叉試験法により比較した試験で
は、両投与経路間のバイオアベイラビリティーは同等であることが確
認されている3)。
16.6 特定の背景を有する患者
慢性腎不全の小児に皮下注射し血中濃度の推移を検討したところ、投
与24時間後には投与前と同程度の濃度を示した4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
〈骨端線閉鎖を伴わない成長ホルモン分泌不全性低身長症〉
17.1.1 国内臨床試験(筋肉内注射)
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を2~3回に分
割して筋肉内注射したとき、ヒト成長ホルモン製剤による前治療歴の
ない16例における1年後の身長の伸びは、無治療時の平均3.5±1.5cm/
年に対して平均7.7±1.8cm/年であり、下垂体抽出ヒト成長ホルモン
製剤による前治療歴のある9例における1年後の身長の伸びは、無治療
時の平均3.3±1.2cm/年に対して平均5.8cm±1.0cm/年であった5)。
副作用は25例中悪心の1例のみであった。
抗ヒト成長ホルモン抗体の発現は、前治療歴のない16例のうち2例に
認められ、前治療歴のある9例では抗体の発現は認められなかった。
17.1.2 国内臨床試験(連日皮下注射)
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を6~7回に
分割して連日皮下注射したとき、ヒト成長ホルモン製剤による前治療
歴のない20例における1年後の身長の伸びは、無治療時の平均3.0±
- 254