よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
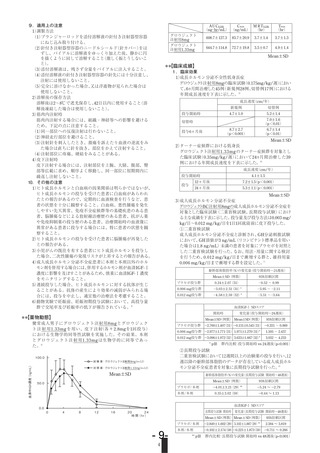
(2)投与4年間の成績
6) 高野
加寿恵ほか.:薬理と治療. 1988;16(1):63-73
比較試験を完了した骨端線閉鎖を伴わないSGA性低身長症患者を対象に長期
7) Takano K. et al.:Endocrinol Jpn. 1989;36(4)
:569-578
試験を実施した。増量群(先行比較試験で0.033mg/kg/日を投与された群)
8) 高野
加寿恵ほか:Progress in Medicine. 1999;19(7)
:1763-1768
29例及び維持群(先行比較試験で0.067mg/kg/日を投与された群)32例に
9) 伊藤
克己ほか.:日本腎臓学会誌. 1995;37(3):186-193
0.067mg/kg/日を1日1回皮下投与したとき、48カ月後までの臨床試験成績の
10)社内資料:骨端線閉鎖を伴わないプラダーウィリー症候群(PWS)におけ
概要は次のとおりであった14)。
評価項目
投与群
増量群
(0.033/0.067
暦年齢相当
mg/kg/日)
成長速度
維持群
a)
SDS
(0.067/0.067
mg/kg/日)
増量群
(0.033/0.067
暦年齢相当
mg/kg/日)
身長
維持群
SDSa)
(0.067/0.067
mg/kg/日)
る臨床効果(2002年1月17日承認、申請資料概要ト1(3))[L20040728061]
試験開始時
12カ月後
24カ月後
36カ月後
48カ月後
-1.87±1.22
(n=29)
2.52±1.79
(n=29)
2.78±1.98
(n=28)
1.81±1.53
(n=26)
1.48±1.54
(n=24)
11)Chihara K. et al.:Growth Horm IGF Res. 2006;16(2)
:132-142
12)社内資料:成人成長ホルモン分泌不全(AGHD)患者に対する長期投与試
験
[L20060607051]
13)社内資料:SGA性低身長症に対する有効性及び安全性(第Ⅲ相試験)(2008
-1.45±1.60
(n=32)
4.77±2.06
(n=32)
2.60±1.73
(n=32)
1.70±2.11
(n=28)
0.82±1.53
(n=23)
-3.14±0.76
(n=29)
-2.53±0.92
(n=29)
-2.02±0.97
(n=28)
-1.80±0.99
(n=26)
-1.48±1.05
(n=24)
-3.09±0.83
(n=32)
-2.17±0.96
(n=32)
-1.70±1.03
(n=32)
-1.53±1.10
(n=28)
-1.49±1.15
(n=23)
年10月16日承認、CTD2.7.6)
[L20080821137]
14)社内資料:SGA性低身長症に対する長期投与時の有効性及び安全性(第Ⅲ
相試験の延長試験)(2008年10月16日承認、CTD2.7.6) [L20080821138]
15)田原
誠ほか.:応用薬理. 2006;70(3-4):53-60
24. 文献請求先及び問い合わせ先
ファイザー株式会社
〒151-8589
n:症例数、平均±SD
a)SDS:標準偏差スコア
なお、投与48カ月後もしくは中止時の身長SDSが標準身長(-2SDから2SD)
製品情報センター
東京都渋谷区代々木3-22-7
学術情報ダイヤル
0120-664-467
FAX
03-3379-3053
26. 製造販売業者等
の下限-2SDを超えた症例は61例中47例(増量群:21例、維持群:26例)であっ
26.1 製造販売元
た。副作用は61例中16例(26.2%)に認められ、主なものは関節痛2例(3.3%)、
頭痛2例(3.3%)、アデノイド肥大2例(3.3%)、白血球増多(症)2例(3.3%)、
ファイザー株式会社
疼痛2例(3.3%)、注射部位反応2例(3.3%)であった。
東京都渋谷区代々木3-22-7
18. 薬効薬理
18.1 作用機序
ソマトロピンは、肝臓に存在する成長ホルモン受容体を介してIGF-Iを誘導
し、このIGF-Iが軟骨細胞に作用して骨格の成長をもたらすと考えられてい
る。また、脂肪分解の促進やトリグリセリドの体脂肪への蓄積抑制などを介
して体組成を改善する。
18.2 IGF-Ⅰ増加作用
下垂体摘出ラット及び健常成人において、血中IGF-I濃度を増加させること
が認められている。また、5/6腎部分摘出ラットにおいて、血中IGF-I濃度を
有意に増加させ、IGF-I活性も高値を示すことが認められている。
18.3 身体成長促進作用
下垂体摘出ラットにより体重増加、軟骨基質合成促進、骨成長促進及び臓器
重量増加の各作用を検討した各試験で、これらの作用はいずれも下垂体抽出
ヒト成長ホルモン製剤とほぼ同等であることが確認されている。また、5/6
腎部分摘出ラットにより用量依存的な体重及び体長が有意に増加することが
確認されている。
18.4 体組成改善作用
下垂体摘出成熟ラットにおいて、本剤単独で除脂肪体重増加、体脂肪率低下、
血中総コレステロール及びLDL脂質濃度低下、並びに血中IGF-I濃度上昇等
の作用が認められている。また、コハク酸ヒドロコルチゾン及びL-チロキシ
ンとの併用試験においても、同様の作用を示すことが確認されている15)。
19. 有効成分に関する理化学的知見
一般的名称:ソマトロピン(遺伝子組換え)
Somatropin(genetical recombination)
化学名:ヒト成長ホルモン(遺伝子組換え)
growth hormone human(genetical recombination)
分子式:C990H1528N262O300S7
分子量:約22,125
化学構造式:191個のアミノ酸からなるペプチド
22. 包装
〈ジェノトロピンゴークイック注用5.3mg〉
1キット
〈ジェノトロピンゴークイック注用12mg〉
1キット
23. 主要文献
1) 社内資料:PNU-180307 12mg(ジェノトロピン注射用12mg(現ジェノト
ロピンTC注用12mg))通常用量での血中濃度及び5.3mg製剤との生物学的
同等性
[L20040520005]
2) Tönshoff B. et al.:Pediatr Nephrol. 1991;5(4)
:454-460
3) Takano K. et al.:Endocrinol Jpn. 1988;35(3)
:477-484
4) 社内資料:慢性腎不全小児における本剤投与後の血中濃度の推移(単回投
与)
5) 高野
[L20040728062]
加寿恵ほか.:薬理と治療. 1987;15(9):3709-3723
- 276
Ⓡ登録商標
010
PAA171983
6) 高野
加寿恵ほか.:薬理と治療. 1988;16(1):63-73
比較試験を完了した骨端線閉鎖を伴わないSGA性低身長症患者を対象に長期
7) Takano K. et al.:Endocrinol Jpn. 1989;36(4)
:569-578
試験を実施した。増量群(先行比較試験で0.033mg/kg/日を投与された群)
8) 高野
加寿恵ほか:Progress in Medicine. 1999;19(7)
:1763-1768
29例及び維持群(先行比較試験で0.067mg/kg/日を投与された群)32例に
9) 伊藤
克己ほか.:日本腎臓学会誌. 1995;37(3):186-193
0.067mg/kg/日を1日1回皮下投与したとき、48カ月後までの臨床試験成績の
10)社内資料:骨端線閉鎖を伴わないプラダーウィリー症候群(PWS)におけ
概要は次のとおりであった14)。
評価項目
投与群
増量群
(0.033/0.067
暦年齢相当
mg/kg/日)
成長速度
維持群
a)
SDS
(0.067/0.067
mg/kg/日)
増量群
(0.033/0.067
暦年齢相当
mg/kg/日)
身長
維持群
SDSa)
(0.067/0.067
mg/kg/日)
る臨床効果(2002年1月17日承認、申請資料概要ト1(3))[L20040728061]
試験開始時
12カ月後
24カ月後
36カ月後
48カ月後
-1.87±1.22
(n=29)
2.52±1.79
(n=29)
2.78±1.98
(n=28)
1.81±1.53
(n=26)
1.48±1.54
(n=24)
11)Chihara K. et al.:Growth Horm IGF Res. 2006;16(2)
:132-142
12)社内資料:成人成長ホルモン分泌不全(AGHD)患者に対する長期投与試
験
[L20060607051]
13)社内資料:SGA性低身長症に対する有効性及び安全性(第Ⅲ相試験)(2008
-1.45±1.60
(n=32)
4.77±2.06
(n=32)
2.60±1.73
(n=32)
1.70±2.11
(n=28)
0.82±1.53
(n=23)
-3.14±0.76
(n=29)
-2.53±0.92
(n=29)
-2.02±0.97
(n=28)
-1.80±0.99
(n=26)
-1.48±1.05
(n=24)
-3.09±0.83
(n=32)
-2.17±0.96
(n=32)
-1.70±1.03
(n=32)
-1.53±1.10
(n=28)
-1.49±1.15
(n=23)
年10月16日承認、CTD2.7.6)
[L20080821137]
14)社内資料:SGA性低身長症に対する長期投与時の有効性及び安全性(第Ⅲ
相試験の延長試験)(2008年10月16日承認、CTD2.7.6) [L20080821138]
15)田原
誠ほか.:応用薬理. 2006;70(3-4):53-60
24. 文献請求先及び問い合わせ先
ファイザー株式会社
〒151-8589
n:症例数、平均±SD
a)SDS:標準偏差スコア
なお、投与48カ月後もしくは中止時の身長SDSが標準身長(-2SDから2SD)
製品情報センター
東京都渋谷区代々木3-22-7
学術情報ダイヤル
0120-664-467
FAX
03-3379-3053
26. 製造販売業者等
の下限-2SDを超えた症例は61例中47例(増量群:21例、維持群:26例)であっ
26.1 製造販売元
た。副作用は61例中16例(26.2%)に認められ、主なものは関節痛2例(3.3%)、
頭痛2例(3.3%)、アデノイド肥大2例(3.3%)、白血球増多(症)2例(3.3%)、
ファイザー株式会社
疼痛2例(3.3%)、注射部位反応2例(3.3%)であった。
東京都渋谷区代々木3-22-7
18. 薬効薬理
18.1 作用機序
ソマトロピンは、肝臓に存在する成長ホルモン受容体を介してIGF-Iを誘導
し、このIGF-Iが軟骨細胞に作用して骨格の成長をもたらすと考えられてい
る。また、脂肪分解の促進やトリグリセリドの体脂肪への蓄積抑制などを介
して体組成を改善する。
18.2 IGF-Ⅰ増加作用
下垂体摘出ラット及び健常成人において、血中IGF-I濃度を増加させること
が認められている。また、5/6腎部分摘出ラットにおいて、血中IGF-I濃度を
有意に増加させ、IGF-I活性も高値を示すことが認められている。
18.3 身体成長促進作用
下垂体摘出ラットにより体重増加、軟骨基質合成促進、骨成長促進及び臓器
重量増加の各作用を検討した各試験で、これらの作用はいずれも下垂体抽出
ヒト成長ホルモン製剤とほぼ同等であることが確認されている。また、5/6
腎部分摘出ラットにより用量依存的な体重及び体長が有意に増加することが
確認されている。
18.4 体組成改善作用
下垂体摘出成熟ラットにおいて、本剤単独で除脂肪体重増加、体脂肪率低下、
血中総コレステロール及びLDL脂質濃度低下、並びに血中IGF-I濃度上昇等
の作用が認められている。また、コハク酸ヒドロコルチゾン及びL-チロキシ
ンとの併用試験においても、同様の作用を示すことが確認されている15)。
19. 有効成分に関する理化学的知見
一般的名称:ソマトロピン(遺伝子組換え)
Somatropin(genetical recombination)
化学名:ヒト成長ホルモン(遺伝子組換え)
growth hormone human(genetical recombination)
分子式:C990H1528N262O300S7
分子量:約22,125
化学構造式:191個のアミノ酸からなるペプチド
22. 包装
〈ジェノトロピンゴークイック注用5.3mg〉
1キット
〈ジェノトロピンゴークイック注用12mg〉
1キット
23. 主要文献
1) 社内資料:PNU-180307 12mg(ジェノトロピン注射用12mg(現ジェノト
ロピンTC注用12mg))通常用量での血中濃度及び5.3mg製剤との生物学的
同等性
[L20040520005]
2) Tönshoff B. et al.:Pediatr Nephrol. 1991;5(4)
:454-460
3) Takano K. et al.:Endocrinol Jpn. 1988;35(3)
:477-484
4) 社内資料:慢性腎不全小児における本剤投与後の血中濃度の推移(単回投
与)
5) 高野
[L20040728062]
加寿恵ほか.:薬理と治療. 1987;15(9):3709-3723
- 276
Ⓡ登録商標
010
PAA171983