よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
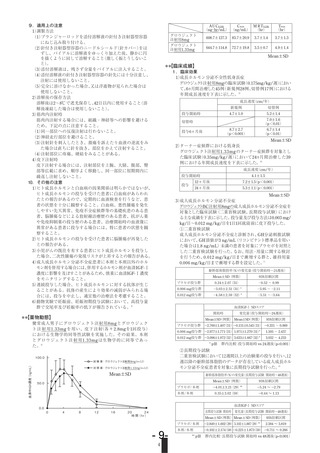
17. 臨床成績
成長促進効果
17.1 有効性及び安全性に関する試験
投与開始時
投与1年後
治療群(n=15)
5.06±2.00
11.65±2.27
無治療群(n=12)
6.35±1.91
4.96±1.24
〈骨端線閉鎖を伴わない成長ホルモン分泌不全性低身長症〉
成長速度(cm/年)
17.1.1 国内臨床試験(筋肉内注射)
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を2~3回に分
n:症例数、値は平均値±SDを記載
割して筋肉内注射したとき、ヒト成長ホルモン製剤による前治療歴の
試験期間中に5例に副作用が認められ、浮腫2例、攻撃性1例、毛髪脱
ない16例における1年後の身長の伸びは、無治療時の平均3.5±1.5cm/
落1例、関節痛1例、体重増加1例及び下肢不安定1例であった。
年に対して平均7.7±1.8cm/年であり、下垂体抽出ヒト成長ホルモン
〈成人成長ホルモン分泌不全症(重症に限る)〉
製剤による前治療歴のある9例における1年後の身長の伸びは、無治療
17.1.7 国内第Ⅲ相試験(二重盲検群間比較試験)
時の平均3.3±1.2cm/年に対して平均5.8cm±1.0cm/年であった5)。
成人成長ホルモン分泌不全症患者と診断され、GH分泌刺激試験にて
副作用は25例中悪心の1例のみであった。
GH頂値が3ng/mL未満の患者(成人期発症35例、小児期発症38例)を
抗ヒト成長ホルモン抗体の発現は、前治療歴のない16例のうち2例に
対象にプラセボ対照二重盲検比較試験を実施した。実薬群37例(成人
認められ、前治療歴のある9例では抗体の発現は認められなかった。
期発症18例、小児期発症19例)及びプラセボ群36例(成人期発症17例、
17.1.2 国内臨床試験(連日皮下注射)
小児期発症19例)に投与開始から投与4週間後までは0.021mg/kg/週、
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を6~7回に
投与4週から投与8週後までは0.042mg/kg/週、投与8週から投与24週
分割して連日皮下注射したとき、ヒト成長ホルモン製剤による前治療
後までは0.084mg/kg/週を1日1回皮下注射したとき、臨床試験成績の
歴のない20例における1年後の身長の伸びは、無治療時の平均3.0±
概略は次のとおりであった11)。
1.0cm/年に対して平均11.0±3.0cm/年であり、遺伝子組換えヒト成長
項目
ホルモン製剤(r-hGH)による筋肉内注射の前治療歴がある18例にお
投与群
試験開始時
24週後
変化率(%)
(p値a))
実薬群
(n=37)
41.48±9.77
43.38±10.30
4.72±5.25
[2.97,6.47]
(p<0.0001)
プラセボ群
(n=36)
39.93±10.34
1.03±4.38
40.41±11.01 [-0.45,2.51]
(p=0.1338)
ける1年後の身長の伸びは、無治療時の平均3.1±1.4cm/年に対して平
均7.8±1.5cm/年であった。ソマトレム(m-hGH)注)による筋肉内注
除脂肪
体重c)
(kg)
射の前治療歴がある9例における1年後の身長の伸びは、無治療時の平
6)
均3.8±0.8cm/年に対して平均9.3±3.2cm/年であった 。
特記すべき副作用は認められなかった。
ヒト成長ホルモン抗体の発現は、投与前に抗体が検出されていない40
群間差(%)
(p値b))
3.69
[1.43,5.95]
(p=0.0003)
平均±SD[両側95%信頼区間]
a)群内比較:Wilcoxon符号付き順位検定
b)群間比較:Wilcoxon順位和検定
c)除脂肪体重測定:DXA法
例のうち前治療歴のない2例に新たに認められた。投与前抗体陽性例7
例(r-hGH前治療歴例1例、m-hGH前治療歴例6例)では、m-hGH前
治療歴例5例で試験の経過とともに抗体価が低下し、うち2例で陰性化
した。
項目
注)ソマトレムは現在国内で市販されていない。
〈骨端線閉鎖を伴わないターナー症候群における低身長〉
投与群
実薬群
血清
(n=37)
IGF-I
濃度
(ng/mL) プラセボ群
(n=36)
17.1.3 国内臨床試験
ターナー症候群の患者に0.35mg/kg/週を6~7回に分割して連日皮下
注射したとき、47例における1年後の身長の伸びは、無治療時の平均3.5
±0.9cm/年に対して平均6.3±1.4cm/年であった7)。
0.35mg/kg/週を投与された患者において自覚的な副作用はなく、特
試験開始時
77.12±60.19
83.33±50.51
変化量
(p値a))
24週後
群間差
(p値b))
161.85±113.30
238.97±143.60 [124.08,199.63]
157.62
(p<0.0001)
[119.27,
195.97]
4.23±22.16
87.56±54.66 [-3.27,11.73] (p<0.0001)
(p=0.2672)
平均±SD[両側95%信頼区間]
a)群内比較:Wilcoxon符号付き順位検定
b)群間比較:Wilcoxon順位和検定
記すべき臨床検査値の変動も認められなかった。
17.1.4 国内臨床試験(成長ホルモン分泌不全を示さないターナー症候
群)
実薬群における副作用は37例中22例(59.5%)に認められた。その主
成長ホルモン分泌不全を示さないターナー症候群の患者に0.175mg/
なものは、浮腫8例(21.6%)、関節痛4例(10.8%)、筋脱力4例(10.8%)
であった。
kg/週を6~7回に分割して連日皮下注射したとき、24例における1年後
17.1.8 国内第Ⅲ相試験(長期投与試験)
の身長の伸びは、無治療時の平均4.4±1.0cm/年に対して平均6.4±
1.3cm/年であった8)。
二重盲検比較試験を完了した成人成長ホルモン分泌不全症患者を対象
投与中の副作用は心雑音1例、水疱1例、湿疹1例であった。臨床検査
に長期投与試験を実施した。二重盲検比較試験から本剤が継続投与さ
値の異常変動は因果関係がありとされたものはなく、因果関係が不明
れた本剤/本剤投与群35例(成人期発症17例、小児期発症18例)及び
とされた異常変動は14例であった。主な異常変動はNEFA上昇3例、尿
本試験から本剤投与を開始したプラセボ/本剤投与群36例(成人期発
沈渣に赤血球出現2例、トリグリセライド上昇2例であった。
症17例、小児期発症19例)に投与開始から投与8週間後までは0.021mg/
kg/週、投与8週以降は血清IGF-I濃度を参考に用量調整を行い1日1回
〈骨端線閉鎖を伴わない慢性腎不全における低身長〉
皮下注射したとき、臨床試験成績の概略は次のとおりであった12)。
17.1.5 国内第Ⅱ相試験
慢性腎不全保存期の患者36例に0.175mg/kg/週、慢性腎不全透析期の
項目
投与群
長期投与試験
開始時
48週後
変化率(%)
本剤/本剤
43.85±10.26
44.38±10.41
1.25±4.23
[-0.20,2.71]
プラセボ
/本剤
40.41±11.01
42.14±11.02
4.66±5.94
[2.65,6.67]
患者のうち27例に0.175mg/kg/週、31例に0.35mg/kg/週を6~7回に
分割して連日皮下注射したとき、保存期群における1年後の身長の伸び
除脂肪体重a)
(kg)
は、無治療時の平均4.2±2.6cm/年に対して平均6.2±2.0cm/年であっ
た。透析期0.175mg/kg/週投与群における1年後の身長の伸びは、無治
療時の平均2.7±1.8cm/年に対して平均5.2±2.6cm/年であり、透析期
平均±SD[両側95%信頼区間]
a)除脂肪体重測定:DXA法
0.35mg/kg/週投与群における1年後の身長の伸びは、無治療時の平均
3.0±1.5cm/年に対して平均6.3±2.2cm/年であった9)。
主な副作用は保存期群でALP上昇3例、耐糖能異常2例、BUN及び血清
項目
投与群
長期投与試験
開始時
48週後
変化量
249.30±140.71
190.18±73.16
-59.13±143.05
[-108.27,-9.99]
87.56±54.66
203.74±91.01
116.18±96.94
[83.38,148.98]
クレアチニン上昇2例であった。透析群では注射部位の硬結及びかゆ
血清IGF-I 本剤/本剤
濃度
(ng/mL) プラセボ
/本剤
みもしくは痛み3例、ヘモグロビンA1及びヘモグロビンA1Cの上昇2例
であった。
〈骨端線閉鎖を伴わないプラダーウィリー症候群における低身長〉
17.1.6 海外第Ⅱ/Ⅲ相臨床試験(スウェーデン/デンマーク)
平均±SD[両側95%信頼区間]
思 春 期 前 の プ ラ ダ ー ウ ィ リ ー 症 候 群 患 者15例 に 治 療 群 と し て
副作用は71例中44例(62.0%)に認められ、そのうち本剤/本剤投与群
0.033mg/kg/日を皮下注射し、12例に無治療群として1年間は食事療
が35例中29例(82.9%)及びプラセボ/本剤投与群が36例中15例(41.7%)
法のみで観察を行い、2年目は0.066mg/kg/日を皮下注射したとき、
であった。主な副作用は、ALP上昇9例(12.7%)
、浮腫9例(12.7%)
、
臨床試験成績の概要は次のとおりであった10)。
感情不安定8例(11.3%)、関節痛7例(9.9%)、筋脱力7例(9.9%)、思
考異常7例(9.9%)、血尿7例(9.9%)であった。
- 205
成長促進効果
17.1 有効性及び安全性に関する試験
投与開始時
投与1年後
治療群(n=15)
5.06±2.00
11.65±2.27
無治療群(n=12)
6.35±1.91
4.96±1.24
〈骨端線閉鎖を伴わない成長ホルモン分泌不全性低身長症〉
成長速度(cm/年)
17.1.1 国内臨床試験(筋肉内注射)
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を2~3回に分
n:症例数、値は平均値±SDを記載
割して筋肉内注射したとき、ヒト成長ホルモン製剤による前治療歴の
試験期間中に5例に副作用が認められ、浮腫2例、攻撃性1例、毛髪脱
ない16例における1年後の身長の伸びは、無治療時の平均3.5±1.5cm/
落1例、関節痛1例、体重増加1例及び下肢不安定1例であった。
年に対して平均7.7±1.8cm/年であり、下垂体抽出ヒト成長ホルモン
〈成人成長ホルモン分泌不全症(重症に限る)〉
製剤による前治療歴のある9例における1年後の身長の伸びは、無治療
17.1.7 国内第Ⅲ相試験(二重盲検群間比較試験)
時の平均3.3±1.2cm/年に対して平均5.8cm±1.0cm/年であった5)。
成人成長ホルモン分泌不全症患者と診断され、GH分泌刺激試験にて
副作用は25例中悪心の1例のみであった。
GH頂値が3ng/mL未満の患者(成人期発症35例、小児期発症38例)を
抗ヒト成長ホルモン抗体の発現は、前治療歴のない16例のうち2例に
対象にプラセボ対照二重盲検比較試験を実施した。実薬群37例(成人
認められ、前治療歴のある9例では抗体の発現は認められなかった。
期発症18例、小児期発症19例)及びプラセボ群36例(成人期発症17例、
17.1.2 国内臨床試験(連日皮下注射)
小児期発症19例)に投与開始から投与4週間後までは0.021mg/kg/週、
成長ホルモン分泌不全性低身長症患者に0.175mg/kg/週を6~7回に
投与4週から投与8週後までは0.042mg/kg/週、投与8週から投与24週
分割して連日皮下注射したとき、ヒト成長ホルモン製剤による前治療
後までは0.084mg/kg/週を1日1回皮下注射したとき、臨床試験成績の
歴のない20例における1年後の身長の伸びは、無治療時の平均3.0±
概略は次のとおりであった11)。
1.0cm/年に対して平均11.0±3.0cm/年であり、遺伝子組換えヒト成長
項目
ホルモン製剤(r-hGH)による筋肉内注射の前治療歴がある18例にお
投与群
試験開始時
24週後
変化率(%)
(p値a))
実薬群
(n=37)
41.48±9.77
43.38±10.30
4.72±5.25
[2.97,6.47]
(p<0.0001)
プラセボ群
(n=36)
39.93±10.34
1.03±4.38
40.41±11.01 [-0.45,2.51]
(p=0.1338)
ける1年後の身長の伸びは、無治療時の平均3.1±1.4cm/年に対して平
均7.8±1.5cm/年であった。ソマトレム(m-hGH)注)による筋肉内注
除脂肪
体重c)
(kg)
射の前治療歴がある9例における1年後の身長の伸びは、無治療時の平
6)
均3.8±0.8cm/年に対して平均9.3±3.2cm/年であった 。
特記すべき副作用は認められなかった。
ヒト成長ホルモン抗体の発現は、投与前に抗体が検出されていない40
群間差(%)
(p値b))
3.69
[1.43,5.95]
(p=0.0003)
平均±SD[両側95%信頼区間]
a)群内比較:Wilcoxon符号付き順位検定
b)群間比較:Wilcoxon順位和検定
c)除脂肪体重測定:DXA法
例のうち前治療歴のない2例に新たに認められた。投与前抗体陽性例7
例(r-hGH前治療歴例1例、m-hGH前治療歴例6例)では、m-hGH前
治療歴例5例で試験の経過とともに抗体価が低下し、うち2例で陰性化
した。
項目
注)ソマトレムは現在国内で市販されていない。
〈骨端線閉鎖を伴わないターナー症候群における低身長〉
投与群
実薬群
血清
(n=37)
IGF-I
濃度
(ng/mL) プラセボ群
(n=36)
17.1.3 国内臨床試験
ターナー症候群の患者に0.35mg/kg/週を6~7回に分割して連日皮下
注射したとき、47例における1年後の身長の伸びは、無治療時の平均3.5
±0.9cm/年に対して平均6.3±1.4cm/年であった7)。
0.35mg/kg/週を投与された患者において自覚的な副作用はなく、特
試験開始時
77.12±60.19
83.33±50.51
変化量
(p値a))
24週後
群間差
(p値b))
161.85±113.30
238.97±143.60 [124.08,199.63]
157.62
(p<0.0001)
[119.27,
195.97]
4.23±22.16
87.56±54.66 [-3.27,11.73] (p<0.0001)
(p=0.2672)
平均±SD[両側95%信頼区間]
a)群内比較:Wilcoxon符号付き順位検定
b)群間比較:Wilcoxon順位和検定
記すべき臨床検査値の変動も認められなかった。
17.1.4 国内臨床試験(成長ホルモン分泌不全を示さないターナー症候
群)
実薬群における副作用は37例中22例(59.5%)に認められた。その主
成長ホルモン分泌不全を示さないターナー症候群の患者に0.175mg/
なものは、浮腫8例(21.6%)、関節痛4例(10.8%)、筋脱力4例(10.8%)
であった。
kg/週を6~7回に分割して連日皮下注射したとき、24例における1年後
17.1.8 国内第Ⅲ相試験(長期投与試験)
の身長の伸びは、無治療時の平均4.4±1.0cm/年に対して平均6.4±
1.3cm/年であった8)。
二重盲検比較試験を完了した成人成長ホルモン分泌不全症患者を対象
投与中の副作用は心雑音1例、水疱1例、湿疹1例であった。臨床検査
に長期投与試験を実施した。二重盲検比較試験から本剤が継続投与さ
値の異常変動は因果関係がありとされたものはなく、因果関係が不明
れた本剤/本剤投与群35例(成人期発症17例、小児期発症18例)及び
とされた異常変動は14例であった。主な異常変動はNEFA上昇3例、尿
本試験から本剤投与を開始したプラセボ/本剤投与群36例(成人期発
沈渣に赤血球出現2例、トリグリセライド上昇2例であった。
症17例、小児期発症19例)に投与開始から投与8週間後までは0.021mg/
kg/週、投与8週以降は血清IGF-I濃度を参考に用量調整を行い1日1回
〈骨端線閉鎖を伴わない慢性腎不全における低身長〉
皮下注射したとき、臨床試験成績の概略は次のとおりであった12)。
17.1.5 国内第Ⅱ相試験
慢性腎不全保存期の患者36例に0.175mg/kg/週、慢性腎不全透析期の
項目
投与群
長期投与試験
開始時
48週後
変化率(%)
本剤/本剤
43.85±10.26
44.38±10.41
1.25±4.23
[-0.20,2.71]
プラセボ
/本剤
40.41±11.01
42.14±11.02
4.66±5.94
[2.65,6.67]
患者のうち27例に0.175mg/kg/週、31例に0.35mg/kg/週を6~7回に
分割して連日皮下注射したとき、保存期群における1年後の身長の伸び
除脂肪体重a)
(kg)
は、無治療時の平均4.2±2.6cm/年に対して平均6.2±2.0cm/年であっ
た。透析期0.175mg/kg/週投与群における1年後の身長の伸びは、無治
療時の平均2.7±1.8cm/年に対して平均5.2±2.6cm/年であり、透析期
平均±SD[両側95%信頼区間]
a)除脂肪体重測定:DXA法
0.35mg/kg/週投与群における1年後の身長の伸びは、無治療時の平均
3.0±1.5cm/年に対して平均6.3±2.2cm/年であった9)。
主な副作用は保存期群でALP上昇3例、耐糖能異常2例、BUN及び血清
項目
投与群
長期投与試験
開始時
48週後
変化量
249.30±140.71
190.18±73.16
-59.13±143.05
[-108.27,-9.99]
87.56±54.66
203.74±91.01
116.18±96.94
[83.38,148.98]
クレアチニン上昇2例であった。透析群では注射部位の硬結及びかゆ
血清IGF-I 本剤/本剤
濃度
(ng/mL) プラセボ
/本剤
みもしくは痛み3例、ヘモグロビンA1及びヘモグロビンA1Cの上昇2例
であった。
〈骨端線閉鎖を伴わないプラダーウィリー症候群における低身長〉
17.1.6 海外第Ⅱ/Ⅲ相臨床試験(スウェーデン/デンマーク)
平均±SD[両側95%信頼区間]
思 春 期 前 の プ ラ ダ ー ウ ィ リ ー 症 候 群 患 者15例 に 治 療 群 と し て
副作用は71例中44例(62.0%)に認められ、そのうち本剤/本剤投与群
0.033mg/kg/日を皮下注射し、12例に無治療群として1年間は食事療
が35例中29例(82.9%)及びプラセボ/本剤投与群が36例中15例(41.7%)
法のみで観察を行い、2年目は0.066mg/kg/日を皮下注射したとき、
であった。主な副作用は、ALP上昇9例(12.7%)
、浮腫9例(12.7%)
、
臨床試験成績の概要は次のとおりであった10)。
感情不安定8例(11.3%)、関節痛7例(9.9%)、筋脱力7例(9.9%)、思
考異常7例(9.9%)、血尿7例(9.9%)であった。
- 205