よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
〈骨端線閉鎖を伴わないSGA性低身長症〉
22. 包装
17.1.9 国内第Ⅲ相試験
〈ジェノトロピンTC注用5.3mg〉
(1)投与1年間の成績
1カートリッジ
〈ジェノトロピンTC注用12mg〉
骨端線閉鎖を伴わないSGA性低身長症患者34例に0.033mg/kg/日、33例に
0.067mg/kg/日を1日1回皮下投与したとき、臨床試験成績の概要は次のとお
1カートリッジ
りであった13)。
暦年齢相当
成長速度
SDSa)
症例数
試験
開始時
12カ月後
変化量
0.033
mg/kg/日
34
-1.86±1.15
2.58±1.85
4.44±1.99
0.067
mg/kg/日
33
-1.43±1.58
4.70±2.06
23. 主要文献
群間の比較b)
投与群
主要評価項目
12カ月後
変化量
p<0.0001
p=0.0028
1) 社内資料:PNU-180307 12mg(ジェノトロピン注射用12mg(現ジェノト
ロピンTC注用12mg))通常用量での血中濃度及び5.3mg製剤との生物学的
同等性
[L20040520005]
2) Tönshoff B. et al.:Pediatr Nephrol. 1991;5(4)
:454-460
6.12±2.23
3) Takano K. et al.:Endocrinol Jpn. 1988;35(3)
:477-484
4) 社内資料:慢性腎不全小児における本剤投与後の血中濃度の推移
(単回投与)
平均±SD
a)標準偏差スコア
b)Wilcoxon順位和検定
[L20040728062]
5) 高野
加寿恵ほか.:薬理と治療. 1987;15(9):3709-3723
副作用は67例中15例(22.4%)認められ、主なものは注射部位出血3例(4.5%)、
6) 高野
加寿恵ほか.:薬理と治療. 1988;16(1):63-73
頭痛2例(3.0%)及び伝染性軟いぼ2例(3.0%)であった。
7) Takano K. et al.:Endocrinol Jpn. 1989;36(4)
:569-578
8) 高野
加寿恵ほか:Progress in Medicine. 1999;19(7)
:1763-1768
比較試験を完了した骨端線閉鎖を伴わないSGA性低身長症患者を対象に長期
9) 伊藤
克己ほか.:日本腎臓学会誌. 1995;37(3):186-193
試験を実施した。増量群(先行比較試験で0.033mg/kg/日を投与された群)
10)社内資料:骨端線閉鎖を伴わないプラダーウィリー症候群(PWS)におけ
(2)投与4年間の成績
る臨床効果(2002年1月17日承認、申請資料概要ト1(3))[L20040728061]
29例及び維持群(先行比較試験で0.067mg/kg/日を投与された群)32例に
0.067mg/kg/日を1日1回皮下投与したとき、48カ月後までの臨床試験成績の
11)Chihara K. et al.:Growth Horm IGF Res. 2006;16(2)
:132-142
概要は次のとおりであった14)。
12)社内資料:成人成長ホルモン分泌不全(AGHD)患者に対する長期投与試
評価項目
暦年齢相当
成長速度
SDSa)
投与群
試験開始時
12カ月後
24カ月後
36カ月後
増量群
(0.033/0.067
mg/kg/日)
-1.87±1.22
(n=29)
維持群
(0.067/0.067
mg/kg/日)
-1.45±1.60
(n=32)
4.77±2.06
(n=32)
2.60±1.73
(n=32)
1.70±2.11
(n=28)
0.82±1.53
(n=23)
-3.14±0.76
(n=29)
-2.53±0.92
(n=29)
-2.02±0.97
(n=28)
-1.80±0.99
(n=26)
-1.48±1.05
(n=24)
増量群
(0.033/0.067
暦年齢相当
mg/kg/日)
身長
維持群
a)
SDS
(0.067/0.067
mg/kg/日)
2.52±1.79
(n=29)
2.78±1.98
(n=28)
1.81±1.53
(n=26)
験
48カ月後
[L20060607051]
13)社内資料:SGA性低身長症に対する有効性及び安全性(第Ⅲ相試験)(2008
1.48±1.54
(n=24)
年10月16日承認、CTD2.7.6)
[L20080821137]
14)社内資料:SGA性低身長症に対する長期投与時の有効性及び安全性(第Ⅲ
相試験の延長試験)(2008年10月16日承認、CTD2.7.6) [L20080821138]
15)田原
誠ほか.:応用薬理. 2006;70(3-4):53-60
24. 文献請求先及び問い合わせ先
ファイザー株式会社
〒151-8589
-3.09±0.83
(n=32)
-2.17±0.96
(n=32)
-1.70±1.03
(n=32)
-1.53±1.10
(n=28)
-1.49±1.15
(n=23)
n:症例数、平均±SD
a)SDS:標準偏差スコア
製品情報センター
東京都渋谷区代々木3-22-7
学術情報ダイヤル
0120-664-467
FAX
03-3379-3053
26. 製造販売業者等
26.1 製造販売元
なお、投与48カ月後もしくは中止時の身長SDSが標準身長(-2SDから2SD)
の下限-2SDを超えた症例は61例中47例(増量群:21例、維持群:26例)であっ
ファイザー株式会社
た。副作用は61例中16例(26.2%)に認められ、主なものは関節痛2例(3.3%)、
東京都渋谷区代々木3-22-7
頭痛2例(3.3%)、アデノイド肥大2例(3.3%)、白血球増多(症)2例(3.3%)、
疼痛2例(3.3%)、注射部位反応2例(3.3%)であった。
18. 薬効薬理
18.1 作用機序
ソマトロピンは、肝臓に存在する成長ホルモン受容体を介してIGF-Iを誘導
し、このIGF-Iが軟骨細胞に作用して骨格の成長をもたらすと考えられてい
る。また、脂肪分解の促進やトリグリセリドの体脂肪への蓄積抑制などを介
して体組成を改善する。
18.2 IGF-Ⅰ増加作用
下垂体摘出ラット及び健常成人において、血中IGF-I濃度を増加させること
が認められている。また、5/6腎部分摘出ラットにおいて、血中IGF-I濃度を
有意に増加させ、IGF-I活性も高値を示すことが認められている。
18.3 身体成長促進作用
下垂体摘出ラットにより体重増加、軟骨基質合成促進、骨成長促進及び臓器重
量増加の各作用を検討した各試験で、これらの作用はいずれも下垂体抽出ヒト成
長ホルモン製剤とほぼ同等であることが確認されている。また、
5/6腎部分摘出ラッ
トにより用量依存的な体重及び体長が有意に増加することが確認されている。
18.4 体組成改善作用
下垂体摘出成熟ラットにおいて、本剤単独で除脂肪体重増加、体脂肪率低下、
血中総コレステロール及びLDL脂質濃度低下、並びに血中IGF-I濃度上昇等
の作用が認められている。また、コハク酸ヒドロコルチゾン及びL-チロキシ
ンとの併用試験においても、同様の作用を示すことが確認されている15)。
19. 有効成分に関する理化学的知見
一般的名称:ソマトロピン(遺伝子組換え)
Somatropin(genetical recombination)
化学名:ヒト成長ホルモン(遺伝子組換え)
growth hormone human(genetical recombination)
分子式:C990H1528N262O300S7
分子量:約22,125
化学構造式:191個のアミノ酸からなるペプチド
- 216
Ⓡ登録商標
011
PAA171982
22. 包装
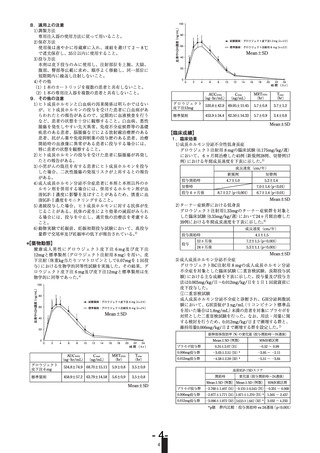
17.1.9 国内第Ⅲ相試験
〈ジェノトロピンTC注用5.3mg〉
(1)投与1年間の成績
1カートリッジ
〈ジェノトロピンTC注用12mg〉
骨端線閉鎖を伴わないSGA性低身長症患者34例に0.033mg/kg/日、33例に
0.067mg/kg/日を1日1回皮下投与したとき、臨床試験成績の概要は次のとお
1カートリッジ
りであった13)。
暦年齢相当
成長速度
SDSa)
症例数
試験
開始時
12カ月後
変化量
0.033
mg/kg/日
34
-1.86±1.15
2.58±1.85
4.44±1.99
0.067
mg/kg/日
33
-1.43±1.58
4.70±2.06
23. 主要文献
群間の比較b)
投与群
主要評価項目
12カ月後
変化量
p<0.0001
p=0.0028
1) 社内資料:PNU-180307 12mg(ジェノトロピン注射用12mg(現ジェノト
ロピンTC注用12mg))通常用量での血中濃度及び5.3mg製剤との生物学的
同等性
[L20040520005]
2) Tönshoff B. et al.:Pediatr Nephrol. 1991;5(4)
:454-460
6.12±2.23
3) Takano K. et al.:Endocrinol Jpn. 1988;35(3)
:477-484
4) 社内資料:慢性腎不全小児における本剤投与後の血中濃度の推移
(単回投与)
平均±SD
a)標準偏差スコア
b)Wilcoxon順位和検定
[L20040728062]
5) 高野
加寿恵ほか.:薬理と治療. 1987;15(9):3709-3723
副作用は67例中15例(22.4%)認められ、主なものは注射部位出血3例(4.5%)、
6) 高野
加寿恵ほか.:薬理と治療. 1988;16(1):63-73
頭痛2例(3.0%)及び伝染性軟いぼ2例(3.0%)であった。
7) Takano K. et al.:Endocrinol Jpn. 1989;36(4)
:569-578
8) 高野
加寿恵ほか:Progress in Medicine. 1999;19(7)
:1763-1768
比較試験を完了した骨端線閉鎖を伴わないSGA性低身長症患者を対象に長期
9) 伊藤
克己ほか.:日本腎臓学会誌. 1995;37(3):186-193
試験を実施した。増量群(先行比較試験で0.033mg/kg/日を投与された群)
10)社内資料:骨端線閉鎖を伴わないプラダーウィリー症候群(PWS)におけ
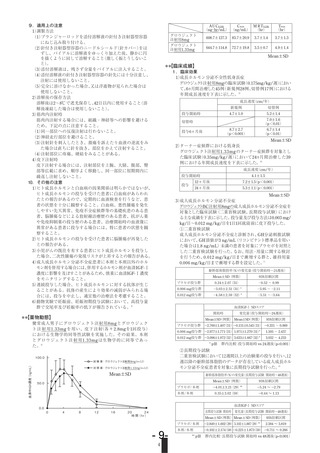
(2)投与4年間の成績
る臨床効果(2002年1月17日承認、申請資料概要ト1(3))[L20040728061]
29例及び維持群(先行比較試験で0.067mg/kg/日を投与された群)32例に
0.067mg/kg/日を1日1回皮下投与したとき、48カ月後までの臨床試験成績の
11)Chihara K. et al.:Growth Horm IGF Res. 2006;16(2)
:132-142
概要は次のとおりであった14)。
12)社内資料:成人成長ホルモン分泌不全(AGHD)患者に対する長期投与試
評価項目
暦年齢相当
成長速度
SDSa)
投与群
試験開始時
12カ月後
24カ月後
36カ月後
増量群
(0.033/0.067
mg/kg/日)
-1.87±1.22
(n=29)
維持群
(0.067/0.067
mg/kg/日)
-1.45±1.60
(n=32)
4.77±2.06
(n=32)
2.60±1.73
(n=32)
1.70±2.11
(n=28)
0.82±1.53
(n=23)
-3.14±0.76
(n=29)
-2.53±0.92
(n=29)
-2.02±0.97
(n=28)
-1.80±0.99
(n=26)
-1.48±1.05
(n=24)
増量群
(0.033/0.067
暦年齢相当
mg/kg/日)
身長
維持群
a)
SDS
(0.067/0.067
mg/kg/日)
2.52±1.79
(n=29)
2.78±1.98
(n=28)
1.81±1.53
(n=26)
験
48カ月後
[L20060607051]
13)社内資料:SGA性低身長症に対する有効性及び安全性(第Ⅲ相試験)(2008
1.48±1.54
(n=24)
年10月16日承認、CTD2.7.6)
[L20080821137]
14)社内資料:SGA性低身長症に対する長期投与時の有効性及び安全性(第Ⅲ
相試験の延長試験)(2008年10月16日承認、CTD2.7.6) [L20080821138]
15)田原
誠ほか.:応用薬理. 2006;70(3-4):53-60
24. 文献請求先及び問い合わせ先
ファイザー株式会社
〒151-8589
-3.09±0.83
(n=32)
-2.17±0.96
(n=32)
-1.70±1.03
(n=32)
-1.53±1.10
(n=28)
-1.49±1.15
(n=23)
n:症例数、平均±SD
a)SDS:標準偏差スコア
製品情報センター
東京都渋谷区代々木3-22-7
学術情報ダイヤル
0120-664-467
FAX
03-3379-3053
26. 製造販売業者等
26.1 製造販売元
なお、投与48カ月後もしくは中止時の身長SDSが標準身長(-2SDから2SD)
の下限-2SDを超えた症例は61例中47例(増量群:21例、維持群:26例)であっ
ファイザー株式会社
た。副作用は61例中16例(26.2%)に認められ、主なものは関節痛2例(3.3%)、
東京都渋谷区代々木3-22-7
頭痛2例(3.3%)、アデノイド肥大2例(3.3%)、白血球増多(症)2例(3.3%)、
疼痛2例(3.3%)、注射部位反応2例(3.3%)であった。
18. 薬効薬理
18.1 作用機序
ソマトロピンは、肝臓に存在する成長ホルモン受容体を介してIGF-Iを誘導
し、このIGF-Iが軟骨細胞に作用して骨格の成長をもたらすと考えられてい
る。また、脂肪分解の促進やトリグリセリドの体脂肪への蓄積抑制などを介
して体組成を改善する。
18.2 IGF-Ⅰ増加作用
下垂体摘出ラット及び健常成人において、血中IGF-I濃度を増加させること
が認められている。また、5/6腎部分摘出ラットにおいて、血中IGF-I濃度を
有意に増加させ、IGF-I活性も高値を示すことが認められている。
18.3 身体成長促進作用
下垂体摘出ラットにより体重増加、軟骨基質合成促進、骨成長促進及び臓器重
量増加の各作用を検討した各試験で、これらの作用はいずれも下垂体抽出ヒト成
長ホルモン製剤とほぼ同等であることが確認されている。また、
5/6腎部分摘出ラッ
トにより用量依存的な体重及び体長が有意に増加することが確認されている。
18.4 体組成改善作用
下垂体摘出成熟ラットにおいて、本剤単独で除脂肪体重増加、体脂肪率低下、
血中総コレステロール及びLDL脂質濃度低下、並びに血中IGF-I濃度上昇等
の作用が認められている。また、コハク酸ヒドロコルチゾン及びL-チロキシ
ンとの併用試験においても、同様の作用を示すことが確認されている15)。
19. 有効成分に関する理化学的知見
一般的名称:ソマトロピン(遺伝子組換え)
Somatropin(genetical recombination)
化学名:ヒト成長ホルモン(遺伝子組換え)
growth hormone human(genetical recombination)
分子式:C990H1528N262O300S7
分子量:約22,125
化学構造式:191個のアミノ酸からなるペプチド
- 216
Ⓡ登録商標
011
PAA171982