よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5.7.2 成人期発症型では、頭蓋内器質性疾患の合併ないし既往歴、治
療歴又は周産期異常の既往がある患者のうち、以下のいずれかを満
たすもの。
・成長ホルモンを含む複数の下垂体ホルモンの分泌低下がある患者
で、1種類の成長ホルモン分泌刺激試験における血清(血漿)成
長ホルモン濃度の頂値が重症の基準を満たすもの。
・成長ホルモン単独の分泌低下がある患者で、2種類の成長ホルモ
ン分泌刺激試験における血清(血漿)成長ホルモン濃度の頂値が
重症の基準を満たすもの。
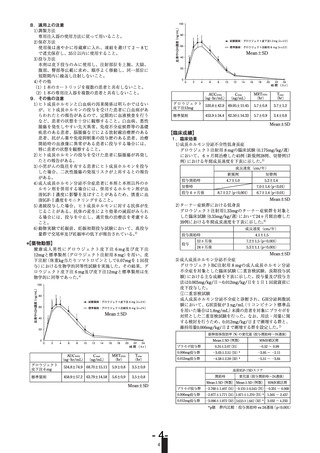
[成長ホルモン分泌刺激試験の種類と成人成長ホルモン分泌不全
症で重症と診断される血清(血漿)成長ホルモン濃度の頂値]
成長ホルモン分泌刺激試験の種類
重症と診断される血清(血漿)成長ホル
モン濃度の頂値
インスリン、アルギニン、グルカゴン
1.8ng/mL以下
GHRP-2
9ng/mL以下
効能・効果
骨 端 線 閉 鎖 を 伴 わ な いSGA(small-for- 通常1週間に体重kg当たり、ソマトロピン
gestational age)性低身長症
(遺伝子組換え)として0.23mgを6~7回に
分けて皮下に注射する。なお、効果不十分
な場合は1週間に体重kg当たり0.47mgまで
増量し、6~7回に分けて皮下に注射する。
なお、専用のソマトロピン注入器を用いて溶解・注射するか、又は
専用の溶解器を用いて溶解、注射する。
〈骨端線閉鎖を伴わないSGA(small-for-gestational age)性低身長症〉
5.8 適用基準
以下のいずれの基準も満たすこと。
5.8.1 出生時
出生時の体重及び身長がともに在胎週数相当の10パーセンタイル未
満で、かつ出生時の体重又は身長のどちらかが、在胎週数相当の-
2SD未満であること。
なお、重症の新生児では出生時に身長が測定できないことがあるの
で、測定されていない場合は、出生体重で判定すること。
5.8.2 治療の開始条件
・3歳以上の患者であること。
・現在の身長が標準身長の-2.5SD未満。
・治療開始前1年間の成長速度が標準成長速度の0SD未満。
5.8.3 出生後の成長障害が子宮内発育遅延以外の疾患等に起因する患
者でないこと。また、成長障害をもたらすと考えられる治療を受け
ている患者でないこと。
5.9 治療継続基準
1年ごとに以下の基準を満たしているかどうかを判定し、いずれか
を満たしたときに治療の継続をする。
・成長速度≧4cm/年
・治療中1年間の成長速度と、投与前1年間の成長速度の差が1.0cm/
年以上の場合。
・治療2年目以降で、治療中1年間の成長速度が下記の場合。
2年目≧2cm/年
3年目以降≧1cm/年
ただし、年間成長速度が、思春期による最大成長時を過ぎて2cm
未満になった場合は中止する。
上記治療継続基準のいずれも満たさないとき、又は骨年齢が男17歳、
女15歳以上に達したときは投与を中止すること。
7. 用法及び用量に関連する注意
〈骨端線閉鎖を伴わない慢性腎不全における低身長〉
7.1 血清クレアチニン等腎機能を定期的に検査し、基礎疾患の進行の
観察を十分に行うこと。腎機能の異常な悪化が認められた場合は投
与を中止すること。本剤の投与に際し、身長の伸びが投与開始6カ
月間で年間成長率に換算して4cm/年未満であり、かつ治療前1年間
の成長率との差が1cm/年未満である場合は投与を中止すること。な
お、治療の継続基準として、6カ月目及び1年目は年間成長率が4cm/
年以上又は治療前1年間の成長率との差が1cm/年以上、2年目は年
間成長率が2cm/年以上、3年目以降は年間成長率が1cm/年以上の場
合は治療を継続できるものとする。ただし、骨年齢が男17歳、女15
歳以上に達したときは投与を中止すること。また、上記継続基準を
満たし、かつ次のいずれかに該当する場合は増量できるものとする。
・慢性腎不全のため同性、同年齢の標準身長の-2SD以下の低身長を
きたし、0.175mg/kg/週の投与を継続しても骨年齢が男17歳、女15
歳に達するまでに標準身長の-2SDまで到達する見込みがない場合
・1年以内に腎移植を予定しており、それまでに0.175mg/kg/週の投
与を継続しても標準身長の-2SDまで到達する見込みがない場合
〈成人成長ホルモン分泌不全症(重症に限る)〉
7.2 本剤の投与量は、血清IGF-I濃度を参照して調整すること。血清
IGF-I濃度は投与開始後24週目までは4週間に1回、それ以降は12週
から24週に1回の測定を目安とすること。また、副作用の発現等の
際は、適宜、血清IGF-I濃度を測定し、本剤の減量、投与中止等適
切な処置をとること。[8.6参照]
7.3 加齢に伴い生理的な成長ホルモンの分泌量や血清IGF-I濃度が低
下することが知られている。本剤投与による症状の改善が認められ
なくなり、かつ本剤を投与しなくても血清IGF-I濃度が基準範囲内
にある場合は、投与中止を考慮すること。[8.6参照]
8. 重要な基本的注意
〈効能共通〉
8.1 耐糖能低下があらわれることがあるため、定期的に尿糖、HbA1C
等の検査を実施することが望ましい。[11.2参照]
8.2 甲状腺機能低下症があらわれることがあるため、甲状腺機能を定
期的に検査し、甲状腺機能低下症があらわれあるいは悪化した場合
には適切な治療を行うことが望ましい。[11.2参照]
〈骨端線閉鎖を伴わないプラダーウィリー症候群における低身長〉
8.3 高度な肥満、呼吸器障害又は睡眠時無呼吸の既往、呼吸器感染の
要因をもつプラダーウィリー症候群の小児患者において、本剤投与
に伴う死亡例が報告されている。また、これら要因をもつ男性患者
ではさらに危険性が高まる可能性がある。
従って、高度な肥満又は重篤な呼吸器障害のある患者には投与しな
いこと。[2.4参照]
また、以下の点に注意すること。
・投与に際し、上気道閉塞がないことを確認すること。本剤投与中
に上気道閉塞の徴候(いびきの発現又は増加等も含む)を示した
場合は、本剤の投与を中止すること。
・睡眠時無呼吸の有無を確認し、睡眠時無呼吸が疑われる場合は観
察を十分に行うこと。
・患者が効果的な体重管理を行っていることを確認すること。
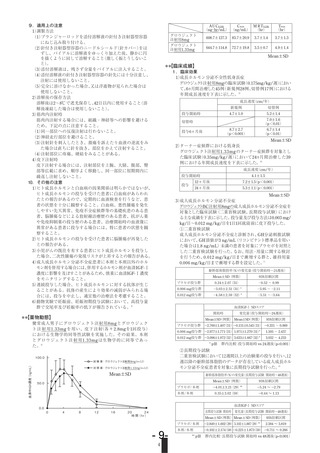
6. 用法及び用量
効能・効果
用法・用量
骨端線閉鎖を伴わない成長ホルモン分泌不 通常1週間に体重kg当たり、ソマトロピン
全性低身長症
(遺伝子組換え)として0.175mgを2~4回
に分けて筋肉内に注射するか、あるいは6
~7回に分けて皮下に注射する。
骨端線閉鎖を伴わない次の疾患における低
身長
ターナー症候群
慢性腎不全
プラダーウィリー症候群
用法・用量
成人成長ホルモン分泌不全症(重症に限る) 通常開始用量として、1週間に体重kg当た
り、ソマトロピン(遺伝子組換え)とし
て0.021mgを6~7回に分けて皮下に注射す
る。患者の臨床症状に応じて1週間に体重
kg当たり0.084mgを上限として漸増し、1
週間に6~7回に分けて皮下に注射する。な
お、投与量は臨床症状及び血清インスリン
様成長因子-I(IGF-I)濃度等の検査所見
に応じて適宜増減する。ただし、1日量と
して1mgを超えないこと。
通常1週間に体重kg当たり、ソマトロピン
(遺伝子組換え)として0.35mgを2~4回に
分けて筋肉内に注射するか、あるいは6~7
回に分けて皮下に注射する。
通 常1週 間 に 体 重kg当 た り、 ソ マ ト ロ ピ
ン(遺伝子組換え)として0.175mgを6~
7回に分けて皮下に注射するが、投与開始
6カ月後以降増量基準に適合した場合は
0.35mgまで増量することができる。
通常1週間に体重kg当たり、ソマトロピン
(遺伝子組換え)として0.245mgを6~7回
に分けて皮下に注射する。
- 172
療歴又は周産期異常の既往がある患者のうち、以下のいずれかを満
たすもの。
・成長ホルモンを含む複数の下垂体ホルモンの分泌低下がある患者
で、1種類の成長ホルモン分泌刺激試験における血清(血漿)成
長ホルモン濃度の頂値が重症の基準を満たすもの。
・成長ホルモン単独の分泌低下がある患者で、2種類の成長ホルモ
ン分泌刺激試験における血清(血漿)成長ホルモン濃度の頂値が
重症の基準を満たすもの。
[成長ホルモン分泌刺激試験の種類と成人成長ホルモン分泌不全
症で重症と診断される血清(血漿)成長ホルモン濃度の頂値]
成長ホルモン分泌刺激試験の種類
重症と診断される血清(血漿)成長ホル
モン濃度の頂値
インスリン、アルギニン、グルカゴン
1.8ng/mL以下
GHRP-2
9ng/mL以下
効能・効果
骨 端 線 閉 鎖 を 伴 わ な いSGA(small-for- 通常1週間に体重kg当たり、ソマトロピン
gestational age)性低身長症
(遺伝子組換え)として0.23mgを6~7回に
分けて皮下に注射する。なお、効果不十分
な場合は1週間に体重kg当たり0.47mgまで
増量し、6~7回に分けて皮下に注射する。
なお、専用のソマトロピン注入器を用いて溶解・注射するか、又は
専用の溶解器を用いて溶解、注射する。
〈骨端線閉鎖を伴わないSGA(small-for-gestational age)性低身長症〉
5.8 適用基準
以下のいずれの基準も満たすこと。
5.8.1 出生時
出生時の体重及び身長がともに在胎週数相当の10パーセンタイル未
満で、かつ出生時の体重又は身長のどちらかが、在胎週数相当の-
2SD未満であること。
なお、重症の新生児では出生時に身長が測定できないことがあるの
で、測定されていない場合は、出生体重で判定すること。
5.8.2 治療の開始条件
・3歳以上の患者であること。
・現在の身長が標準身長の-2.5SD未満。
・治療開始前1年間の成長速度が標準成長速度の0SD未満。
5.8.3 出生後の成長障害が子宮内発育遅延以外の疾患等に起因する患
者でないこと。また、成長障害をもたらすと考えられる治療を受け
ている患者でないこと。
5.9 治療継続基準
1年ごとに以下の基準を満たしているかどうかを判定し、いずれか
を満たしたときに治療の継続をする。
・成長速度≧4cm/年
・治療中1年間の成長速度と、投与前1年間の成長速度の差が1.0cm/
年以上の場合。
・治療2年目以降で、治療中1年間の成長速度が下記の場合。
2年目≧2cm/年
3年目以降≧1cm/年
ただし、年間成長速度が、思春期による最大成長時を過ぎて2cm
未満になった場合は中止する。
上記治療継続基準のいずれも満たさないとき、又は骨年齢が男17歳、
女15歳以上に達したときは投与を中止すること。
7. 用法及び用量に関連する注意
〈骨端線閉鎖を伴わない慢性腎不全における低身長〉
7.1 血清クレアチニン等腎機能を定期的に検査し、基礎疾患の進行の
観察を十分に行うこと。腎機能の異常な悪化が認められた場合は投
与を中止すること。本剤の投与に際し、身長の伸びが投与開始6カ
月間で年間成長率に換算して4cm/年未満であり、かつ治療前1年間
の成長率との差が1cm/年未満である場合は投与を中止すること。な
お、治療の継続基準として、6カ月目及び1年目は年間成長率が4cm/
年以上又は治療前1年間の成長率との差が1cm/年以上、2年目は年
間成長率が2cm/年以上、3年目以降は年間成長率が1cm/年以上の場
合は治療を継続できるものとする。ただし、骨年齢が男17歳、女15
歳以上に達したときは投与を中止すること。また、上記継続基準を
満たし、かつ次のいずれかに該当する場合は増量できるものとする。
・慢性腎不全のため同性、同年齢の標準身長の-2SD以下の低身長を
きたし、0.175mg/kg/週の投与を継続しても骨年齢が男17歳、女15
歳に達するまでに標準身長の-2SDまで到達する見込みがない場合
・1年以内に腎移植を予定しており、それまでに0.175mg/kg/週の投
与を継続しても標準身長の-2SDまで到達する見込みがない場合
〈成人成長ホルモン分泌不全症(重症に限る)〉
7.2 本剤の投与量は、血清IGF-I濃度を参照して調整すること。血清
IGF-I濃度は投与開始後24週目までは4週間に1回、それ以降は12週
から24週に1回の測定を目安とすること。また、副作用の発現等の
際は、適宜、血清IGF-I濃度を測定し、本剤の減量、投与中止等適
切な処置をとること。[8.6参照]
7.3 加齢に伴い生理的な成長ホルモンの分泌量や血清IGF-I濃度が低
下することが知られている。本剤投与による症状の改善が認められ
なくなり、かつ本剤を投与しなくても血清IGF-I濃度が基準範囲内
にある場合は、投与中止を考慮すること。[8.6参照]
8. 重要な基本的注意
〈効能共通〉
8.1 耐糖能低下があらわれることがあるため、定期的に尿糖、HbA1C
等の検査を実施することが望ましい。[11.2参照]
8.2 甲状腺機能低下症があらわれることがあるため、甲状腺機能を定
期的に検査し、甲状腺機能低下症があらわれあるいは悪化した場合
には適切な治療を行うことが望ましい。[11.2参照]
〈骨端線閉鎖を伴わないプラダーウィリー症候群における低身長〉
8.3 高度な肥満、呼吸器障害又は睡眠時無呼吸の既往、呼吸器感染の
要因をもつプラダーウィリー症候群の小児患者において、本剤投与
に伴う死亡例が報告されている。また、これら要因をもつ男性患者
ではさらに危険性が高まる可能性がある。
従って、高度な肥満又は重篤な呼吸器障害のある患者には投与しな
いこと。[2.4参照]
また、以下の点に注意すること。
・投与に際し、上気道閉塞がないことを確認すること。本剤投与中
に上気道閉塞の徴候(いびきの発現又は増加等も含む)を示した
場合は、本剤の投与を中止すること。
・睡眠時無呼吸の有無を確認し、睡眠時無呼吸が疑われる場合は観
察を十分に行うこと。
・患者が効果的な体重管理を行っていることを確認すること。
6. 用法及び用量
効能・効果
用法・用量
骨端線閉鎖を伴わない成長ホルモン分泌不 通常1週間に体重kg当たり、ソマトロピン
全性低身長症
(遺伝子組換え)として0.175mgを2~4回
に分けて筋肉内に注射するか、あるいは6
~7回に分けて皮下に注射する。
骨端線閉鎖を伴わない次の疾患における低
身長
ターナー症候群
慢性腎不全
プラダーウィリー症候群
用法・用量
成人成長ホルモン分泌不全症(重症に限る) 通常開始用量として、1週間に体重kg当た
り、ソマトロピン(遺伝子組換え)とし
て0.021mgを6~7回に分けて皮下に注射す
る。患者の臨床症状に応じて1週間に体重
kg当たり0.084mgを上限として漸増し、1
週間に6~7回に分けて皮下に注射する。な
お、投与量は臨床症状及び血清インスリン
様成長因子-I(IGF-I)濃度等の検査所見
に応じて適宜増減する。ただし、1日量と
して1mgを超えないこと。
通常1週間に体重kg当たり、ソマトロピン
(遺伝子組換え)として0.35mgを2~4回に
分けて筋肉内に注射するか、あるいは6~7
回に分けて皮下に注射する。
通 常1週 間 に 体 重kg当 た り、 ソ マ ト ロ ピ
ン(遺伝子組換え)として0.175mgを6~
7回に分けて皮下に注射するが、投与開始
6カ月後以降増量基準に適合した場合は
0.35mgまで増量することができる。
通常1週間に体重kg当たり、ソマトロピン
(遺伝子組換え)として0.245mgを6~7回
に分けて皮下に注射する。
- 172