よむ、つかう、まなぶ。
資料1-4 ソマトロピン(遺伝子組換え)の電子化された添付文書一覧 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(第3版)
**2020年 3 月改訂
*2017年 1 月改訂
遺伝子組換え天然型ヒト成長ホルモン製剤
皮下注 6mg
皮下注 12mg
処方箋医薬品注)
注射用ソマトロピン
(遺伝子組換え)
貯
法:冷暗所保存(2~8℃)
使用期限:直接容器及び外箱に表示
注)注意ー医師等の処方箋により使用すること
1. 糖尿病の患者[成長ホルモンが抗インスリン様作用
を有するため。]
2. 悪性腫瘍のある患者[成長ホルモンが細胞増殖作用
を有するため。]
3. 妊婦又は妊娠している可能性のある婦人[「妊婦、
産婦、授乳婦等への投与」の項参照。]
【組成・性状】
6 mg
12mg
承認番号 22800AMX00463 22800AMX00464
2016年12月
* 薬価収載
2017年 1 月
* 販売開始
国際誕生
1987年 3 月
【効能・効果に関連する使用上の注意】
**1. 組成
本剤は国内で製剤化した注射剤であり、1カートリッジ
(1.5mL)中に下記成分を含有する。
成
分
含
*1. 成長ホルモン分泌不全性低身長症
本剤の適用は、成長ホルモン分泌不全性低身長症と診断
された患者に限定すること。診断にあたっては、最新の
「厚生労働科学研究費補助金難治性疾患克服研究事業 間
脳下垂体機能障害に関する調査研究班 成長ホルモン分泌
不全性低身長症の診断の手引き」を参照すること。
2. ターナー症候群における低身長
1)ターナー症候群における低身長への適用基準
染色体検査によりターナー症候群と確定診断された者
で、身長が標準身長の-2.0SD以下又は年間の成長速度が
2 年以上にわたって標準値の-1.5SD以下である場合。
2)ターナー症候群における低身長の治療継続基準
1 年ごとに以下の基準を満たしているかどうかを判定し、
いずれかを満たしたときに治療の継続をする。
(1)成長速度≧ 4 cm/年
(2)治療中 1 年間の成長速度と、投与前 1 年間の成長速度
の差が、1.0cm/年以上の場合。
(3)治療 2 年目以降で、治療中 1 年間の成長速度が下記の場合
2 年目
≧ 2 cm/年
3 年目以降≧ 1 cm/年
ただし、以上のいずれも満たさないとき、又は骨年齢が
15歳以上に達したときは投与を中止すること。
*3. 成人成長ホルモン分泌不全症
本剤の適用は、成人成長ホルモン分泌不全症と診断され
た患者のうち、以下のいずれかの患者に限定すること。
なお、重症の基準は、最新の「厚生労働科学研究費補助金
難治性疾患克服研究事業 間脳下垂体機能障害に関する調
査研究班 成人成長ホルモン分泌不全症の診断と治療の手
引き」の病型分類を参照すること。
(1)小児期発症型(小児期に成長ホルモン分泌不全症と確
定診断されている患者)では、以下のいずれかを満た
すもの。ただし、診断にあたっては、本治療開始前に
再度成長ホルモン分泌刺激試験を行うこと。
1)2 種類以上の成長ホルモン分泌刺激試験における血
清(血漿)成長ホルモン濃度の頂値が重症の基準を
満たすもの。
2)頭蓋内器質性疾患の合併ないし既往歴、治療歴また
は周産期異常の既往があり、成長ホルモンを含む複
数の下垂体ホルモンの分泌低下がある患者では、1
種類の成長ホルモン分泌刺激試験における血清(血
漿)成長ホルモン濃度の頂値が重症の基準を満たす
もの。
(2)成人期発症型では、頭蓋内器質性疾患の合併ないし既
往歴、治療歴または周産期異常の既往がある患者のう
ち、以下のいずれかを満たすもの。
1)成長ホルモンを含む複数の下垂体ホルモンの分泌低下
がある患者で、1 種類の成長ホルモン分泌刺激試験に
おける血清(血漿)成長ホルモン濃度の頂値が重症の
基準を満たすもの。
量
グロウジェクト グロウジェクト
皮下注 6 mg 皮下注12mg
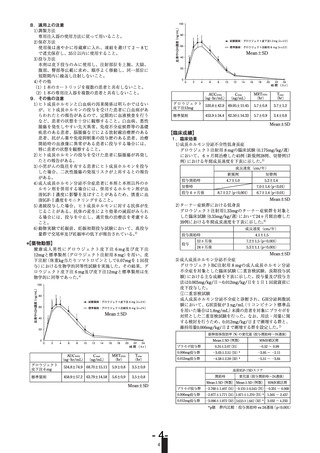
有効成分 ソマトロピン
(遺伝子組換え)
緩衝剤 リン酸二水素ナトリウム
添加物
水和物
pH調節剤 水酸化ナトリウム
リン酸
等張化剤 Dーマンニトール
安定剤 ポリオキシエチレン
(160)
ポリオキシプロ
ピレン
(30)
グリコール
保存剤
フェノール
6 mg
12mg
2.34mg
適量
適量
60mg
3 mg
5 mg
2. 製剤の性状
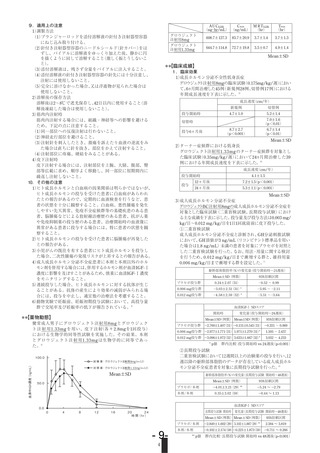
本剤は無色澄明の液である。
本剤のpH及び生理食塩液に対する浸透圧比は次のとおりで
ある。
浸透圧比
日本標準商品分類番号
8 7 2 4 1 2
効能・効果
用法・用量
骨端線閉鎖を伴わない 通常 1 週間に体重 kg 当たり、ソ
SGA(small-for-gestational マトロピン(遺伝子組換え)として
0.23 mg を 6 ~ 7 回に分けて皮下に
age)性低身長症
注射する。なお、効果不十分な場
合は 1 週間に体重kg当たり0.47mg
まで増量し、 6 ~ 7 回に分けて皮
下に注射する。
禁忌(次の患者には投与しないこと)
pH
令和4年3月22日
令和3年度医薬品等
安全対策調査会
資料1-4
6.0~6.4
0.9~1.1
【効能・効果、用法・用量】
効能・効果
用法・用量
骨端線閉鎖を伴わない 通常 1 週間に体重kg当たり、ソマ
成長ホルモン分泌不全 トロピン(遺伝子組換え)として
0.175mgを 6 ~ 7 回に分けて皮下
性低身長症
に注射する。
骨端線閉鎖を伴わない 通常 1 週間に体重kg当たり、ソマ
ターナー症候群におけ トロピン(遺伝子組換え)として
0.35mgを 6 ~ 7 回に分けて皮下に
る低身長
注射する。
成人成長ホルモン分泌 通常開始用量として、 1 週間に体
不全症(重症に限る) 重kg当たり、ソマトロピン(遺伝
子組換え)として0.021mgを 6 ~
7 回に分けて皮下に注射する。患
者の臨床症状に応じて 1 週間に体
重kg当たり0.084mgを上限として
漸増し、 1 週間に 6 ~ 7 回に分け
て皮下に注射する。なお、投与量
は臨床症状及び血清インスリン様
成長因子-Ⅰ(IGF-Ⅰ)濃度等の検査
所見に応じて適宜増減する。ただ
し、 1 日量として 1 mgを超えない
こと。
- 11
**2020年 3 月改訂
*2017年 1 月改訂
遺伝子組換え天然型ヒト成長ホルモン製剤
皮下注 6mg
皮下注 12mg
処方箋医薬品注)
注射用ソマトロピン
(遺伝子組換え)
貯
法:冷暗所保存(2~8℃)
使用期限:直接容器及び外箱に表示
注)注意ー医師等の処方箋により使用すること
1. 糖尿病の患者[成長ホルモンが抗インスリン様作用
を有するため。]
2. 悪性腫瘍のある患者[成長ホルモンが細胞増殖作用
を有するため。]
3. 妊婦又は妊娠している可能性のある婦人[「妊婦、
産婦、授乳婦等への投与」の項参照。]
【組成・性状】
6 mg
12mg
承認番号 22800AMX00463 22800AMX00464
2016年12月
* 薬価収載
2017年 1 月
* 販売開始
国際誕生
1987年 3 月
【効能・効果に関連する使用上の注意】
**1. 組成
本剤は国内で製剤化した注射剤であり、1カートリッジ
(1.5mL)中に下記成分を含有する。
成
分
含
*1. 成長ホルモン分泌不全性低身長症
本剤の適用は、成長ホルモン分泌不全性低身長症と診断
された患者に限定すること。診断にあたっては、最新の
「厚生労働科学研究費補助金難治性疾患克服研究事業 間
脳下垂体機能障害に関する調査研究班 成長ホルモン分泌
不全性低身長症の診断の手引き」を参照すること。
2. ターナー症候群における低身長
1)ターナー症候群における低身長への適用基準
染色体検査によりターナー症候群と確定診断された者
で、身長が標準身長の-2.0SD以下又は年間の成長速度が
2 年以上にわたって標準値の-1.5SD以下である場合。
2)ターナー症候群における低身長の治療継続基準
1 年ごとに以下の基準を満たしているかどうかを判定し、
いずれかを満たしたときに治療の継続をする。
(1)成長速度≧ 4 cm/年
(2)治療中 1 年間の成長速度と、投与前 1 年間の成長速度
の差が、1.0cm/年以上の場合。
(3)治療 2 年目以降で、治療中 1 年間の成長速度が下記の場合
2 年目
≧ 2 cm/年
3 年目以降≧ 1 cm/年
ただし、以上のいずれも満たさないとき、又は骨年齢が
15歳以上に達したときは投与を中止すること。
*3. 成人成長ホルモン分泌不全症
本剤の適用は、成人成長ホルモン分泌不全症と診断され
た患者のうち、以下のいずれかの患者に限定すること。
なお、重症の基準は、最新の「厚生労働科学研究費補助金
難治性疾患克服研究事業 間脳下垂体機能障害に関する調
査研究班 成人成長ホルモン分泌不全症の診断と治療の手
引き」の病型分類を参照すること。
(1)小児期発症型(小児期に成長ホルモン分泌不全症と確
定診断されている患者)では、以下のいずれかを満た
すもの。ただし、診断にあたっては、本治療開始前に
再度成長ホルモン分泌刺激試験を行うこと。
1)2 種類以上の成長ホルモン分泌刺激試験における血
清(血漿)成長ホルモン濃度の頂値が重症の基準を
満たすもの。
2)頭蓋内器質性疾患の合併ないし既往歴、治療歴また
は周産期異常の既往があり、成長ホルモンを含む複
数の下垂体ホルモンの分泌低下がある患者では、1
種類の成長ホルモン分泌刺激試験における血清(血
漿)成長ホルモン濃度の頂値が重症の基準を満たす
もの。
(2)成人期発症型では、頭蓋内器質性疾患の合併ないし既
往歴、治療歴または周産期異常の既往がある患者のう
ち、以下のいずれかを満たすもの。
1)成長ホルモンを含む複数の下垂体ホルモンの分泌低下
がある患者で、1 種類の成長ホルモン分泌刺激試験に
おける血清(血漿)成長ホルモン濃度の頂値が重症の
基準を満たすもの。
量
グロウジェクト グロウジェクト
皮下注 6 mg 皮下注12mg
有効成分 ソマトロピン
(遺伝子組換え)
緩衝剤 リン酸二水素ナトリウム
添加物
水和物
pH調節剤 水酸化ナトリウム
リン酸
等張化剤 Dーマンニトール
安定剤 ポリオキシエチレン
(160)
ポリオキシプロ
ピレン
(30)
グリコール
保存剤
フェノール
6 mg
12mg
2.34mg
適量
適量
60mg
3 mg
5 mg
2. 製剤の性状
本剤は無色澄明の液である。
本剤のpH及び生理食塩液に対する浸透圧比は次のとおりで
ある。
浸透圧比
日本標準商品分類番号
8 7 2 4 1 2
効能・効果
用法・用量
骨端線閉鎖を伴わない 通常 1 週間に体重 kg 当たり、ソ
SGA(small-for-gestational マトロピン(遺伝子組換え)として
0.23 mg を 6 ~ 7 回に分けて皮下に
age)性低身長症
注射する。なお、効果不十分な場
合は 1 週間に体重kg当たり0.47mg
まで増量し、 6 ~ 7 回に分けて皮
下に注射する。
禁忌(次の患者には投与しないこと)
pH
令和4年3月22日
令和3年度医薬品等
安全対策調査会
資料1-4
6.0~6.4
0.9~1.1
【効能・効果、用法・用量】
効能・効果
用法・用量
骨端線閉鎖を伴わない 通常 1 週間に体重kg当たり、ソマ
成長ホルモン分泌不全 トロピン(遺伝子組換え)として
0.175mgを 6 ~ 7 回に分けて皮下
性低身長症
に注射する。
骨端線閉鎖を伴わない 通常 1 週間に体重kg当たり、ソマ
ターナー症候群におけ トロピン(遺伝子組換え)として
0.35mgを 6 ~ 7 回に分けて皮下に
る低身長
注射する。
成人成長ホルモン分泌 通常開始用量として、 1 週間に体
不全症(重症に限る) 重kg当たり、ソマトロピン(遺伝
子組換え)として0.021mgを 6 ~
7 回に分けて皮下に注射する。患
者の臨床症状に応じて 1 週間に体
重kg当たり0.084mgを上限として
漸増し、 1 週間に 6 ~ 7 回に分け
て皮下に注射する。なお、投与量
は臨床症状及び血清インスリン様
成長因子-Ⅰ(IGF-Ⅰ)濃度等の検査
所見に応じて適宜増減する。ただ
し、 1 日量として 1 mgを超えない
こと。
- 11