よむ、つかう、まなぶ。
10参考資料1 新型コロナワクチンに関する資料 (51 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000192554_00027.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第52回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
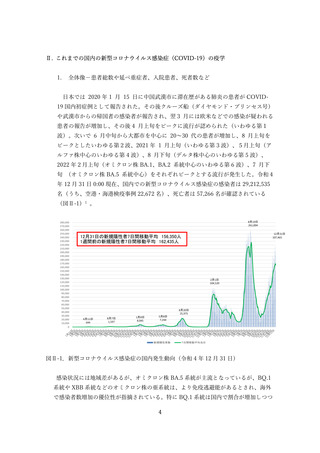
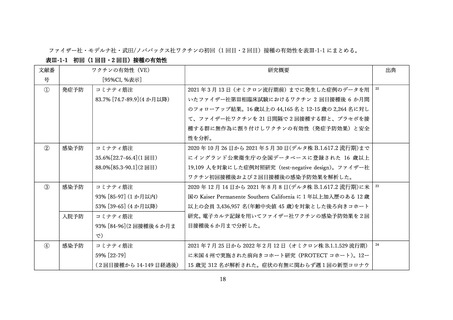
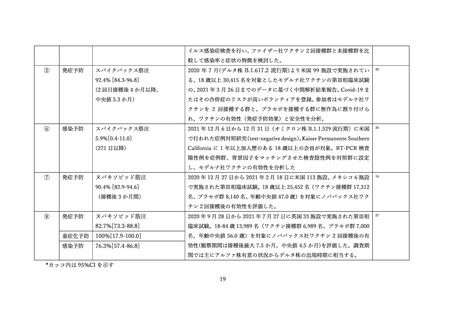
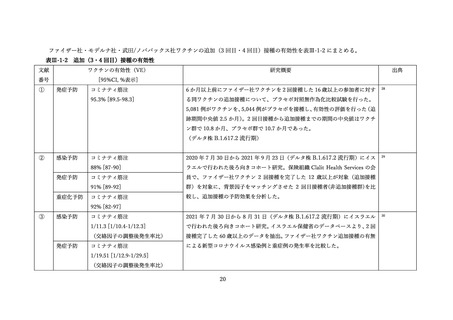
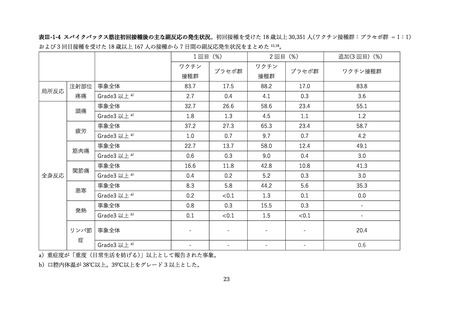
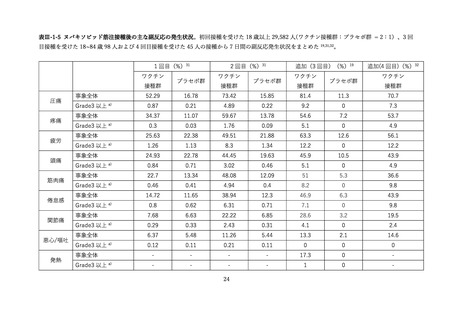
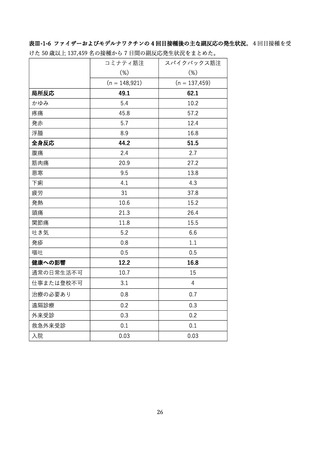
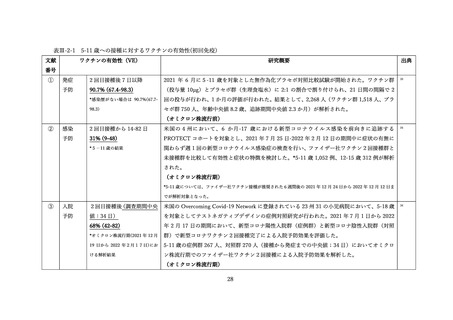
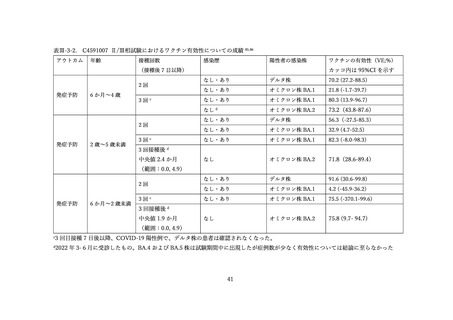
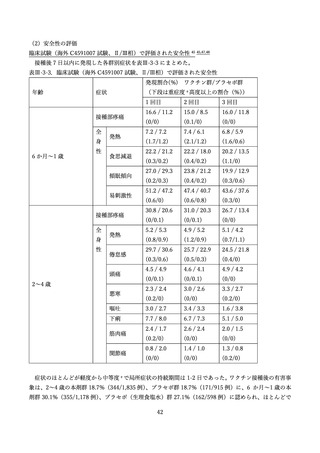
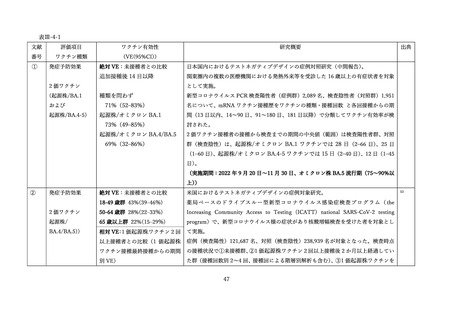
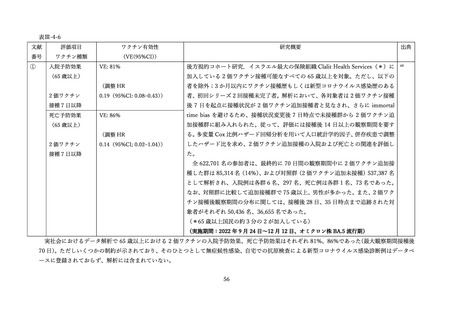
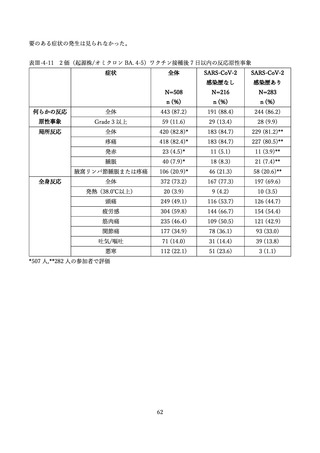
(2) 安全性の評価
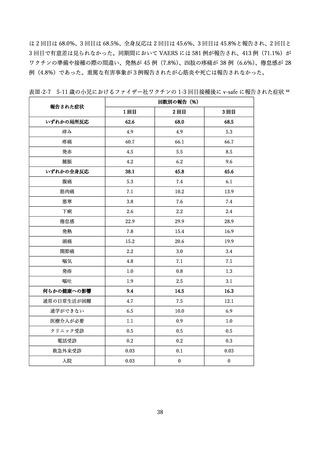
2 価ワクチンの安全性の報告として CDC によるスマートフォンを用いた副反応自発報告(v-safe)と
予防接種後副反応報告システム(Vaccine Adverse Event Reporting System (VAERS))に報告されたファ
イザー社またはモデルナ社のオミクロン株対応 2 価ワクチン(起源株/BA.4-5)の追加接種を受けた 12
歳以上の報告のまとめがなされた(調査時期:オミクロン BA.4/BA.5 流行期(2022 年 8 月 31 日~10 月
23 日)
、調査時点でファイザー社ワクチン(12 歳以上)1,440 万回接種、モデルナ社ワクチン(18 歳以
上)820 万回接種)56。
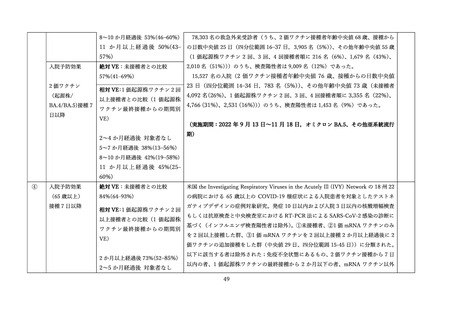
v-safe においては 211,959 件の報告があった。45.4%が 4 回目としての接種者、50.2%が 5 回目として
の接種者であった。39.8%の報告で他のワクチン(うち 98.3%はインフルエンザワクチン)の同時接種が
行われていた。局所症状、全身症状ともに、接種 1 週間以内に多くが報告され(それぞれ 60.8%、54.8%)
、
追加接種後1週間において報告された局所・全身反応の頻度は以下の通りであった。
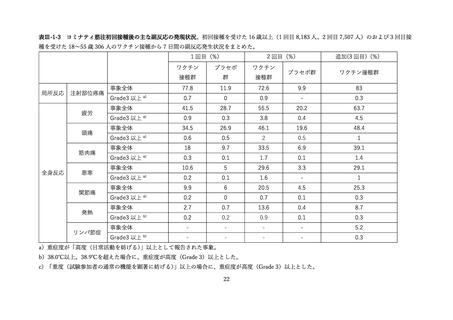
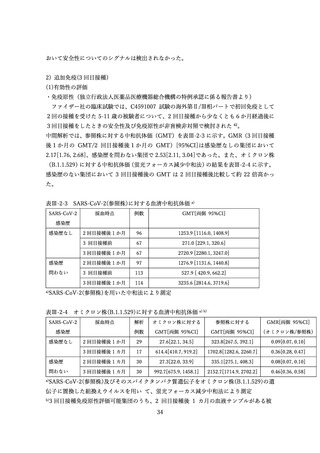
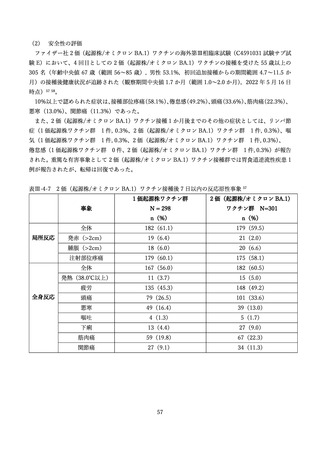
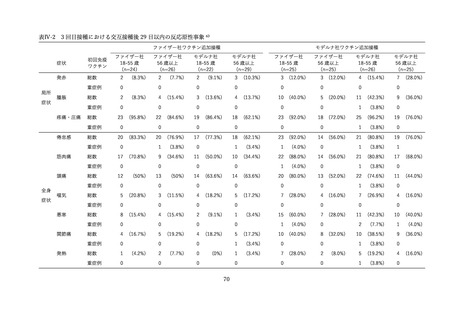
表Ⅲ-4-2 米国 v-safe に報告された 12 歳以上のファイザー社あるいはモデルナ社のオミクロン株対応 2
価ワクチン追加接種後 0~7 日までの報告のまとめ(2022 年 8 月 31 日~10 月 23 日)56 引用翻訳、一
部改変
12–17 歳
18–49 歳
50–64 歳
65 歳以上
全年齢
n=1,464
n=68,592
n=59,209
n=82,694
n=211,959
局所反応
68.7%
72.9%
62.0%
49.7%
60.8%
全身反応
59.8%
67.9%
55.2%
43.5%
54.8%
18.40%
19.80%
14.70%
10.60%
14.80%
1.2%
0.9%
0.7%
0.8%
0.8%
0
0
0
0
0
日常生活が行えない状況
医療的ケアが必要
入院
v-safe において報告の多かった症状は接種部位疼痛、倦怠感、頭痛、筋肉痛、発熱であった。日常生活
が困難であったと報告されたのは 18~49 歳群で 19.8%、50~64 歳群 14.7%、65 歳以上群で 10.6%に上
ったが、医療機関受診、入院を必要とした報告はそれぞれ 0.8%、0.03%であった。
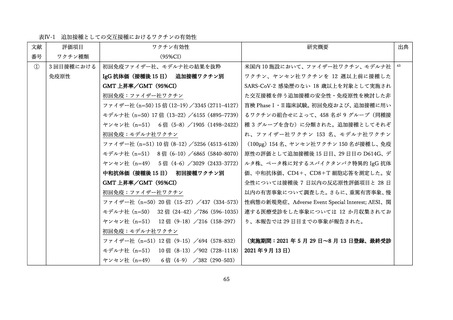
VAERS には 5,542 件の報告(年齢中央値 60 歳(範囲 12~101 歳)
、女性 3,559 例(64.2%))があり、
16.9%で他のワクチン(うち 90.7%はインフルエンザワクチン)の同時接種が行われていた。34.5%(1,913
名)は誤接種関連の報告で、重篤例の報告は 251 件(4.5%)
、心筋炎 5 件(12~78 歳)、心膜炎 4 件(46
~78 歳)
、死亡 36 件(46~98 歳)が含まれた。
51
2 価ワクチンの安全性の報告として CDC によるスマートフォンを用いた副反応自発報告(v-safe)と
予防接種後副反応報告システム(Vaccine Adverse Event Reporting System (VAERS))に報告されたファ
イザー社またはモデルナ社のオミクロン株対応 2 価ワクチン(起源株/BA.4-5)の追加接種を受けた 12
歳以上の報告のまとめがなされた(調査時期:オミクロン BA.4/BA.5 流行期(2022 年 8 月 31 日~10 月
23 日)
、調査時点でファイザー社ワクチン(12 歳以上)1,440 万回接種、モデルナ社ワクチン(18 歳以
上)820 万回接種)56。
v-safe においては 211,959 件の報告があった。45.4%が 4 回目としての接種者、50.2%が 5 回目として
の接種者であった。39.8%の報告で他のワクチン(うち 98.3%はインフルエンザワクチン)の同時接種が
行われていた。局所症状、全身症状ともに、接種 1 週間以内に多くが報告され(それぞれ 60.8%、54.8%)
、
追加接種後1週間において報告された局所・全身反応の頻度は以下の通りであった。
表Ⅲ-4-2 米国 v-safe に報告された 12 歳以上のファイザー社あるいはモデルナ社のオミクロン株対応 2
価ワクチン追加接種後 0~7 日までの報告のまとめ(2022 年 8 月 31 日~10 月 23 日)56 引用翻訳、一
部改変
12–17 歳
18–49 歳
50–64 歳
65 歳以上
全年齢
n=1,464
n=68,592
n=59,209
n=82,694
n=211,959
局所反応
68.7%
72.9%
62.0%
49.7%
60.8%
全身反応
59.8%
67.9%
55.2%
43.5%
54.8%
18.40%
19.80%
14.70%
10.60%
14.80%
1.2%
0.9%
0.7%
0.8%
0.8%
0
0
0
0
0
日常生活が行えない状況
医療的ケアが必要
入院
v-safe において報告の多かった症状は接種部位疼痛、倦怠感、頭痛、筋肉痛、発熱であった。日常生活
が困難であったと報告されたのは 18~49 歳群で 19.8%、50~64 歳群 14.7%、65 歳以上群で 10.6%に上
ったが、医療機関受診、入院を必要とした報告はそれぞれ 0.8%、0.03%であった。
VAERS には 5,542 件の報告(年齢中央値 60 歳(範囲 12~101 歳)
、女性 3,559 例(64.2%))があり、
16.9%で他のワクチン(うち 90.7%はインフルエンザワクチン)の同時接種が行われていた。34.5%(1,913
名)は誤接種関連の報告で、重篤例の報告は 251 件(4.5%)
、心筋炎 5 件(12~78 歳)、心膜炎 4 件(46
~78 歳)
、死亡 36 件(46~98 歳)が含まれた。
51