よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
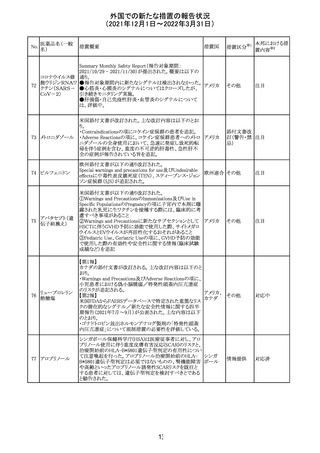
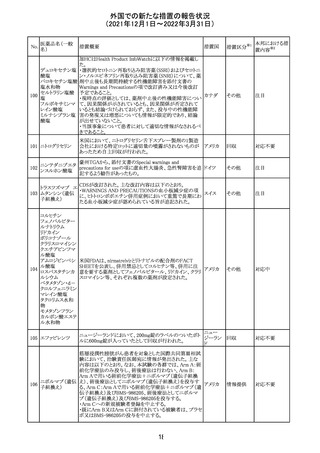
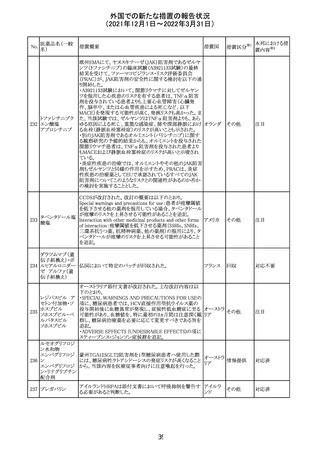
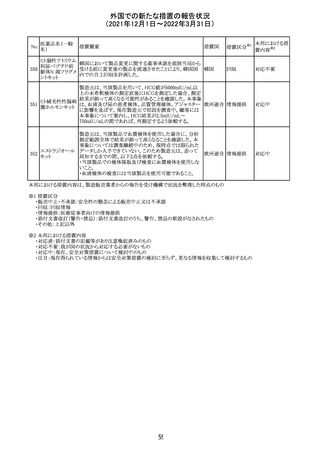
外国での新たな措置の報告状況
(2021年12月1日~2022年3月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
※1
本邦における措
置内容※2
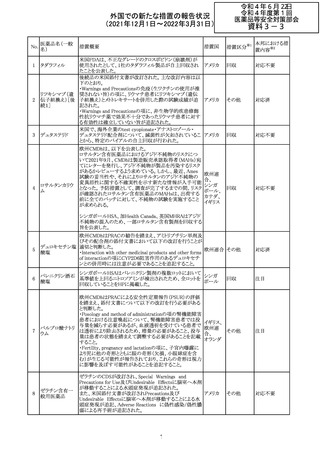
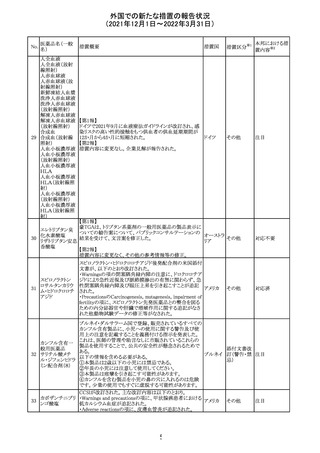
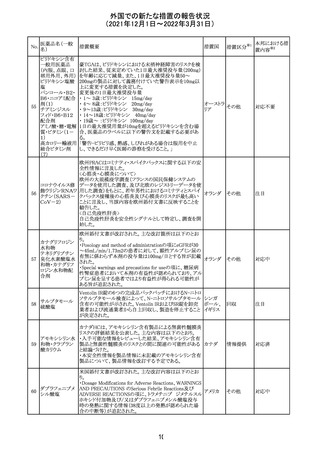
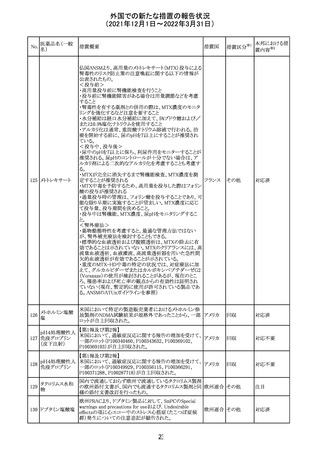
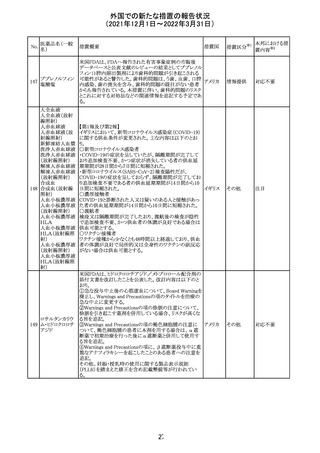
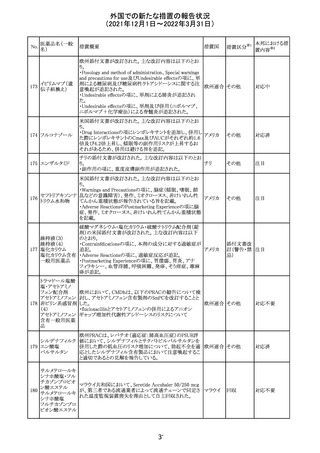
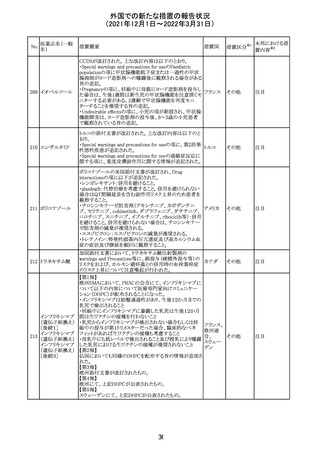
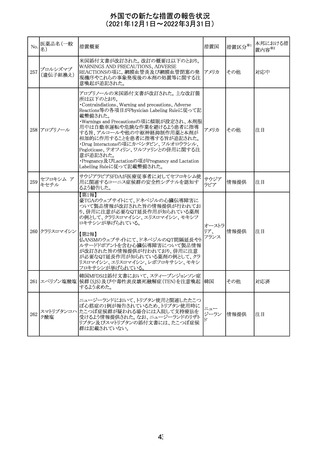
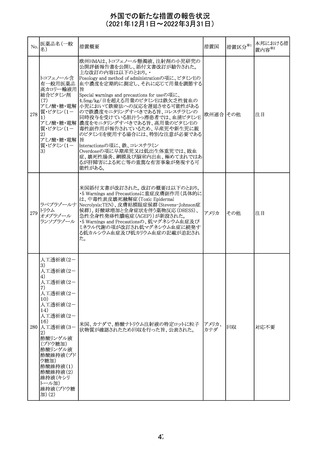
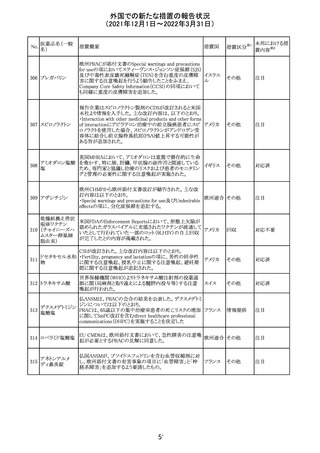
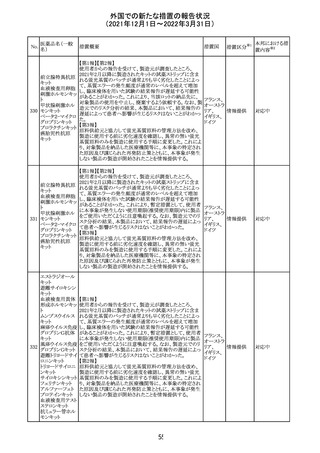
欧州医薬品庁のファーマコビジランスリスク評価委員会
(PRAC)は、デキサメタゾン製剤の欧州添付文書の改訂勧
告を行った。主な内容は以下のとおり。
・Special warnings and precautions for useの項に、「早産児
への投与時に肥大型心筋症が報告されている。全身性デ
キサメタゾン製剤を投与された早産児に対して、診断的評
欧州連合 その他
価、心機能及び心構造のモニタリングを実施すること。」を
追記すること。
・Pregnancyの項に、「早産のリスクがある妊娠後期の女性に
デキサメタゾンを含むコルチコステロイドを投与すると、新生
児低血糖症のリスクが増加することが複数の研究で示され
ている。」を追記すること。
注目
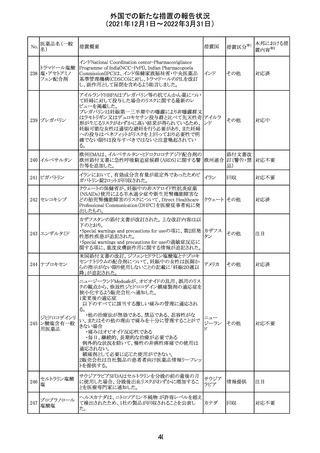
CDSが改訂された。主な改訂内容は以下のとおり。
・P糖たんぱく質の基質であるダビガトランエテキシラートと
の相互作用試験結果を基に、Interaction with Other
アメリカ
Medicaments and Other Forms of Interactionの項に、P糖
たんぱく質の基質との併用時に併用薬の血漿中濃度が増
加する可能性がある旨が追記された。
その他
注目
その他
対応不要
その他
注目
その他
注目
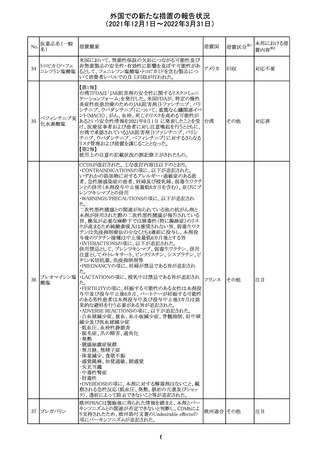
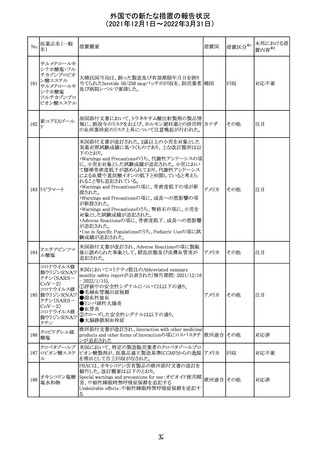
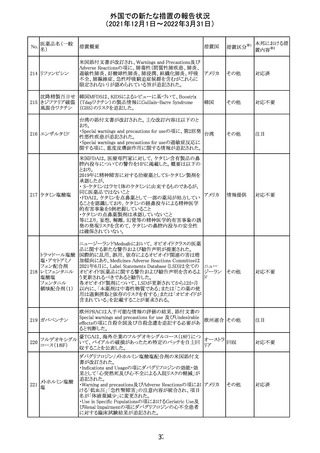
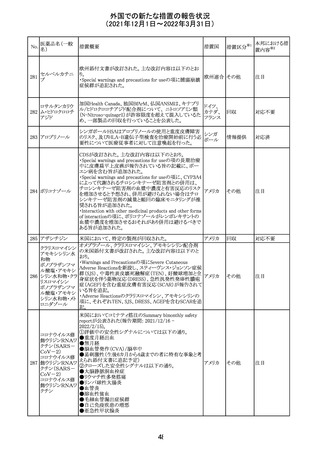
27 メトトレキサート
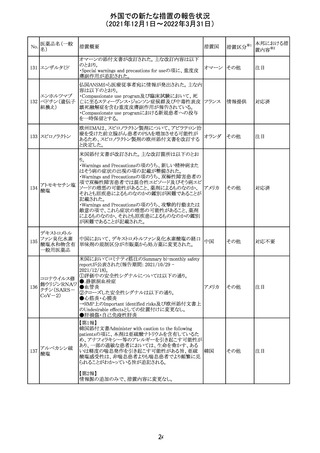
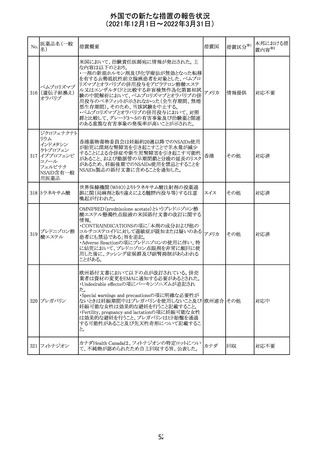
欧州EMAのファーマコビジランス・リスク評価委員会
(PRAC)が本剤の肝毒性について、以下の通り欧州添付文
書のSpecial warnings and precautions for useを改訂するよ
う勧告した。
①肝機能検査で異常のある患者には投与しないこと
②トランスアミナーゼが正常上限の2~3倍に増加すること
があり、これら肝酵素の持続的な上昇及び血清アルブミン
の低下は重度の肝障害であることがあるため、そのような場
合は投与量の軽減や投与中止を考慮すること
欧州連合 その他
③肝硬変等の場合、肝酵素の値が正常の時があるので、
肝臓の状態を確認するための非侵襲的な方法も検討する
こと。肝生検は既往歴、合併症、生検のリスクを考慮して個
別に検討すること。
④必要な場合を除いて、本剤での治療中に肝毒性のある
医薬品の併用をしないこと。飲酒も避けること。これらの患
者ではより綿密なモニタリングが必要になる。
⑤インスリン依存性糖尿病患者で、肝酵素の上昇を伴わな
い肝硬変が認められた報告があるので、注意すること。
注目
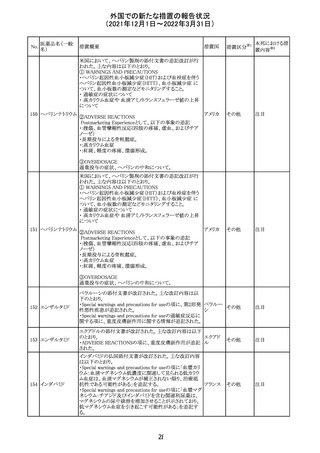
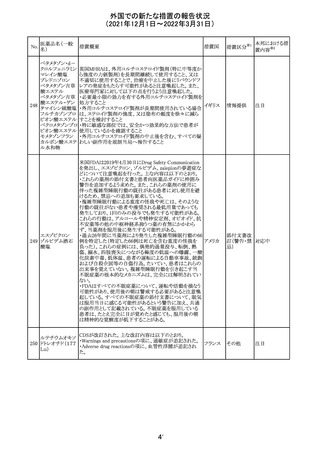
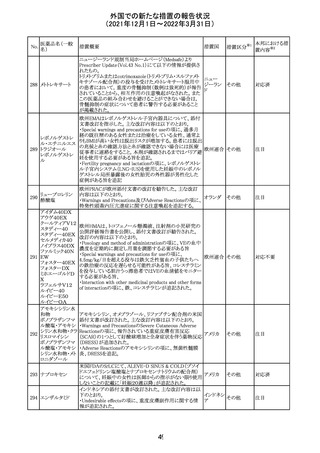
28 リネゾリド
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの項に「低ナトリウム血症および
/または抗利尿ホルモン不適合分泌症候群(SIADH)」を
新設し、リネゾリドで治療された患者において、低ナトリウム
血症・抗利尿ホルモン不適合分泌症候群(以下 SIADH)の
アメリカ
市販後の症例が確認されている旨、高齢者、利尿薬を投与
している患者、本剤投与中に低ナトリウム血症やSIADHのリ
スクがある患者においては、血清ナトリウム値を定期的に測
定する旨、を追記。
・Adverse ReactionsのPostmarketing Experienceの項に、低
ナトリウム血症および/またはSIADHを追記。
注目
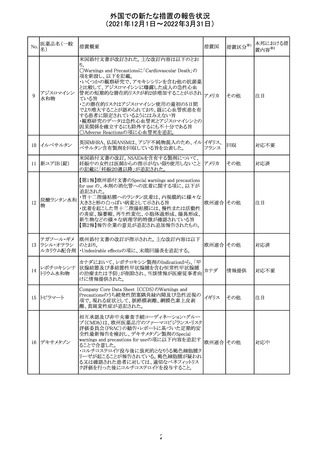
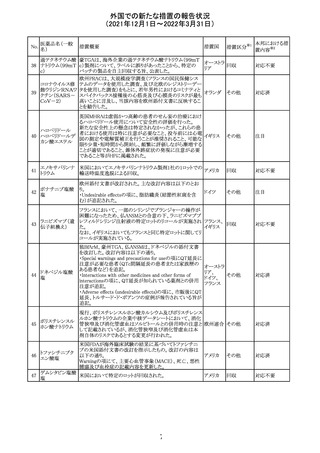
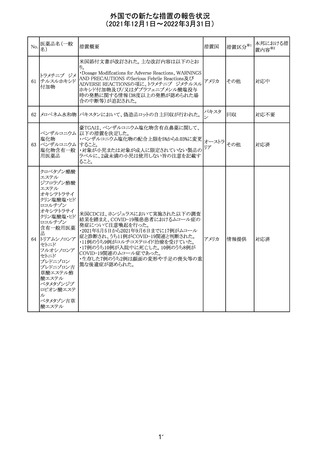
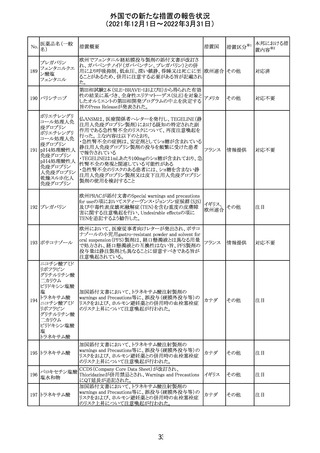
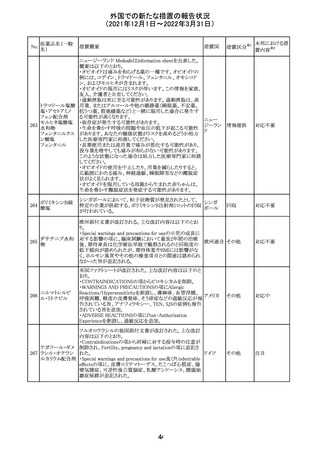
デキサメタゾンリ
ン酸エステルナト
リウム
デキサメタゾン
デキサメタゾン酢
22 酸エステル含有
一般用医薬品
デキサメタゾンメ
タスルホ安息香
酸エステルナトリ
ウム
23
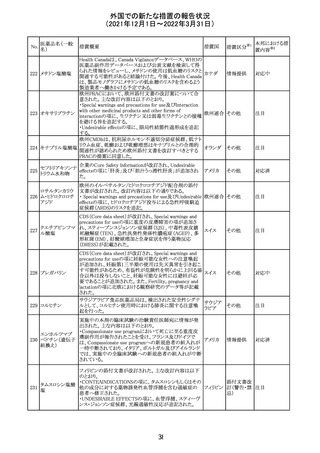
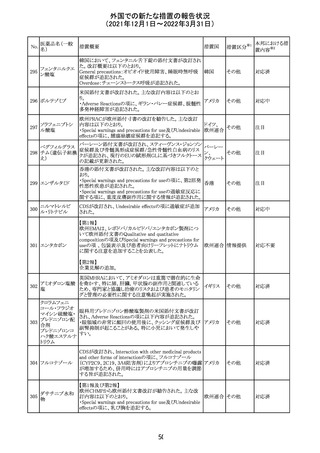
セルペルカチニ
ブ
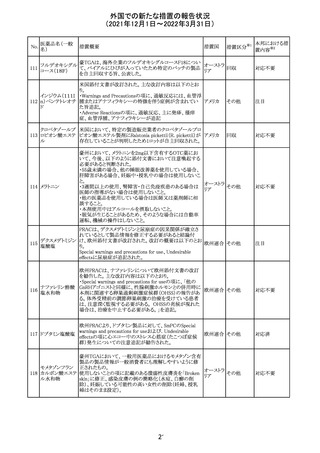
米国添付文書を以下のとおり改訂する。
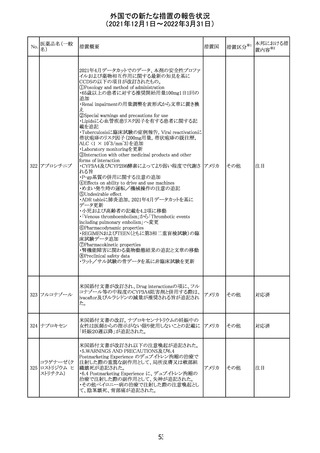
クロルフェニラミン NSAIDsを含有する製剤について、妊娠中の女性は医師か
24
アメリカ
マレイン酸塩
らの指示がない限り使用しないことの記載に「妊娠20週以
降」が追記された。
タクロリムス水和
25
マカオ添付文書が欧州添付文書と同様に改訂された。
マカオ
物
インドの添付文書が改訂された。主な改訂内容は以下のと
おり。
26 エンザルタミド
インド
・Undesirable effecsの項に、重度皮膚副作用が追記され
た。
4
その他
(2021年12月1日~2022年3月31日)
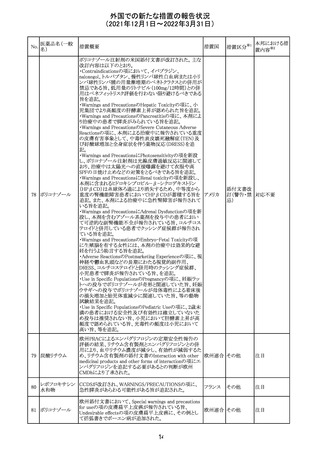
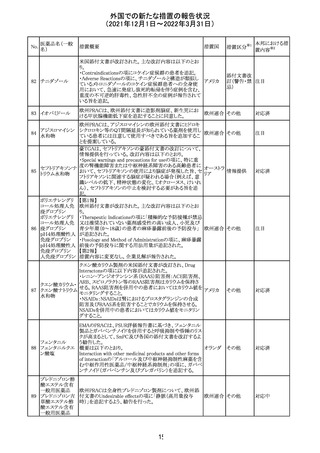
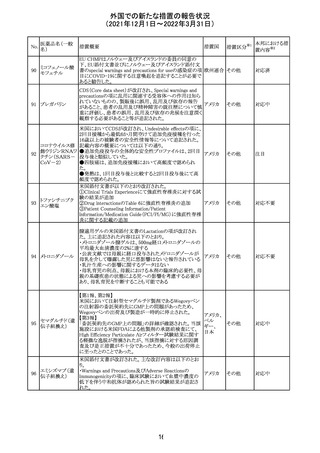
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
※1
本邦における措
置内容※2
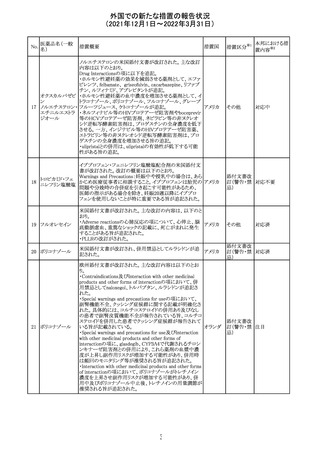
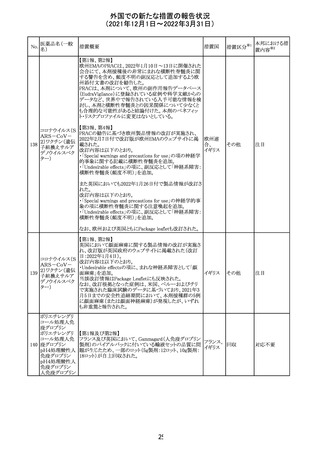
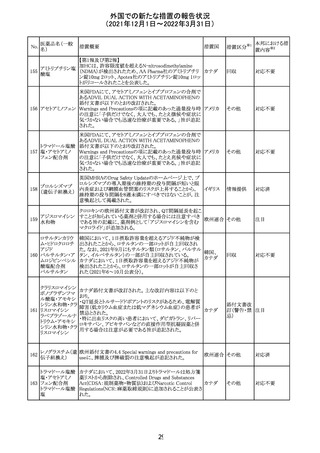
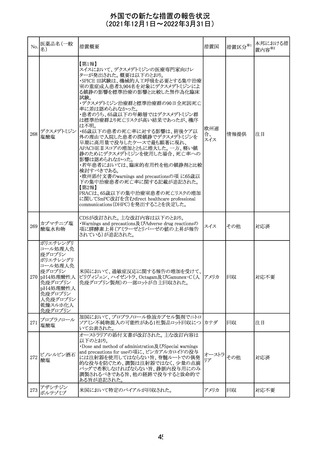
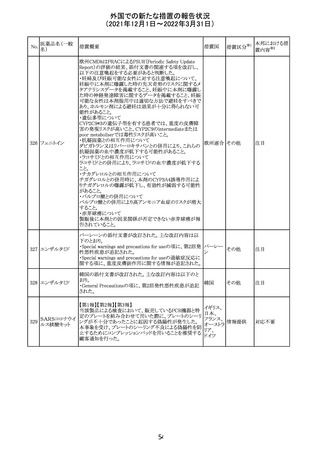
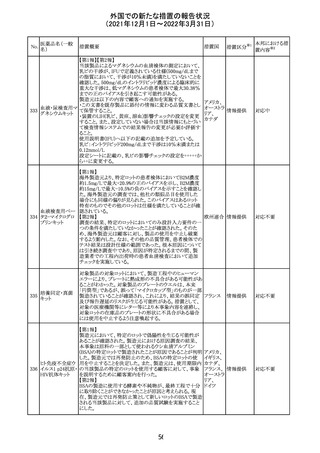
欧州医薬品庁のファーマコビジランスリスク評価委員会
(PRAC)は、デキサメタゾン製剤の欧州添付文書の改訂勧
告を行った。主な内容は以下のとおり。
・Special warnings and precautions for useの項に、「早産児
への投与時に肥大型心筋症が報告されている。全身性デ
キサメタゾン製剤を投与された早産児に対して、診断的評
欧州連合 その他
価、心機能及び心構造のモニタリングを実施すること。」を
追記すること。
・Pregnancyの項に、「早産のリスクがある妊娠後期の女性に
デキサメタゾンを含むコルチコステロイドを投与すると、新生
児低血糖症のリスクが増加することが複数の研究で示され
ている。」を追記すること。
注目
CDSが改訂された。主な改訂内容は以下のとおり。
・P糖たんぱく質の基質であるダビガトランエテキシラートと
の相互作用試験結果を基に、Interaction with Other
アメリカ
Medicaments and Other Forms of Interactionの項に、P糖
たんぱく質の基質との併用時に併用薬の血漿中濃度が増
加する可能性がある旨が追記された。
その他
注目
その他
対応不要
その他
注目
その他
注目
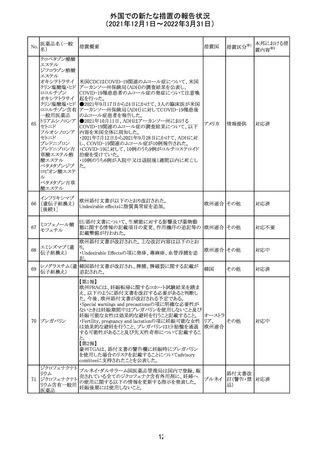
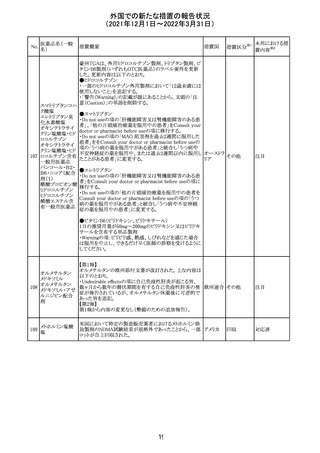
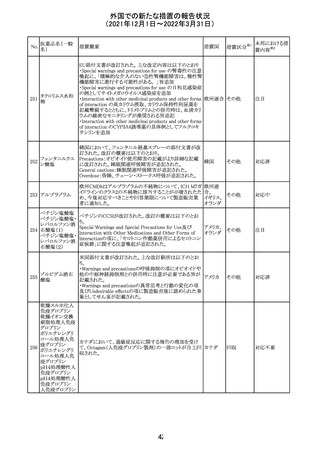
27 メトトレキサート
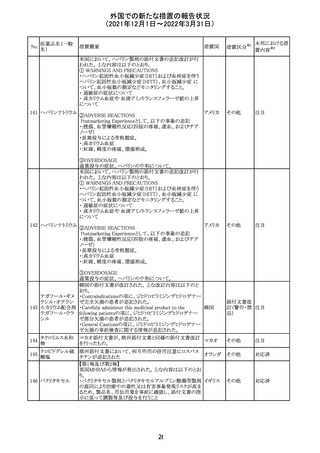
欧州EMAのファーマコビジランス・リスク評価委員会
(PRAC)が本剤の肝毒性について、以下の通り欧州添付文
書のSpecial warnings and precautions for useを改訂するよ
う勧告した。
①肝機能検査で異常のある患者には投与しないこと
②トランスアミナーゼが正常上限の2~3倍に増加すること
があり、これら肝酵素の持続的な上昇及び血清アルブミン
の低下は重度の肝障害であることがあるため、そのような場
合は投与量の軽減や投与中止を考慮すること
欧州連合 その他
③肝硬変等の場合、肝酵素の値が正常の時があるので、
肝臓の状態を確認するための非侵襲的な方法も検討する
こと。肝生検は既往歴、合併症、生検のリスクを考慮して個
別に検討すること。
④必要な場合を除いて、本剤での治療中に肝毒性のある
医薬品の併用をしないこと。飲酒も避けること。これらの患
者ではより綿密なモニタリングが必要になる。
⑤インスリン依存性糖尿病患者で、肝酵素の上昇を伴わな
い肝硬変が認められた報告があるので、注意すること。
注目
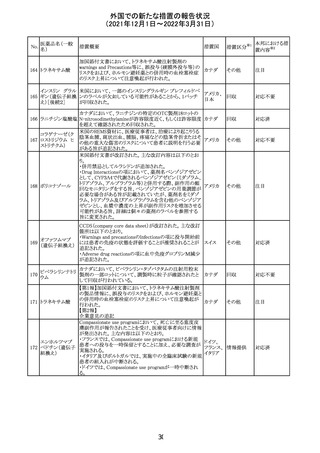
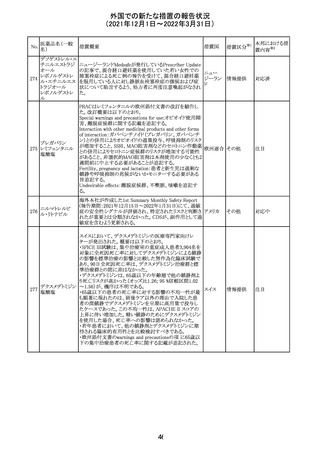
28 リネゾリド
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの項に「低ナトリウム血症および
/または抗利尿ホルモン不適合分泌症候群(SIADH)」を
新設し、リネゾリドで治療された患者において、低ナトリウム
血症・抗利尿ホルモン不適合分泌症候群(以下 SIADH)の
アメリカ
市販後の症例が確認されている旨、高齢者、利尿薬を投与
している患者、本剤投与中に低ナトリウム血症やSIADHのリ
スクがある患者においては、血清ナトリウム値を定期的に測
定する旨、を追記。
・Adverse ReactionsのPostmarketing Experienceの項に、低
ナトリウム血症および/またはSIADHを追記。
注目
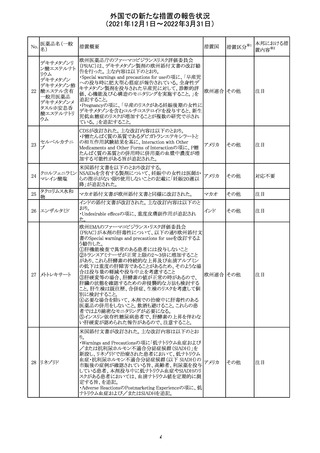
デキサメタゾンリ
ン酸エステルナト
リウム
デキサメタゾン
デキサメタゾン酢
22 酸エステル含有
一般用医薬品
デキサメタゾンメ
タスルホ安息香
酸エステルナトリ
ウム
23
セルペルカチニ
ブ
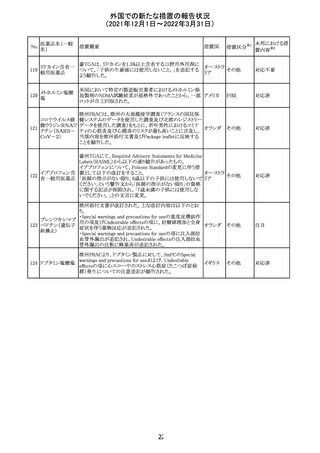
米国添付文書を以下のとおり改訂する。
クロルフェニラミン NSAIDsを含有する製剤について、妊娠中の女性は医師か
24
アメリカ
マレイン酸塩
らの指示がない限り使用しないことの記載に「妊娠20週以
降」が追記された。
タクロリムス水和
25
マカオ添付文書が欧州添付文書と同様に改訂された。
マカオ
物
インドの添付文書が改訂された。主な改訂内容は以下のと
おり。
26 エンザルタミド
インド
・Undesirable effecsの項に、重度皮膚副作用が追記され
た。
4
その他