よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
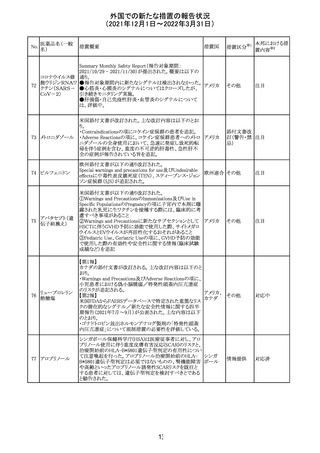
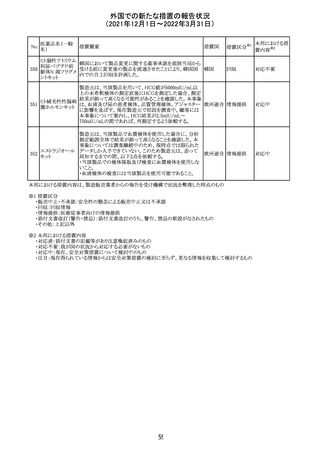
外国での新たな措置の報告状況
(2021年12月1日~2022年3月31日)
No.
医薬品名(一般
名)
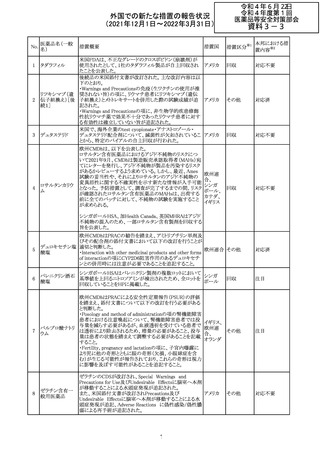
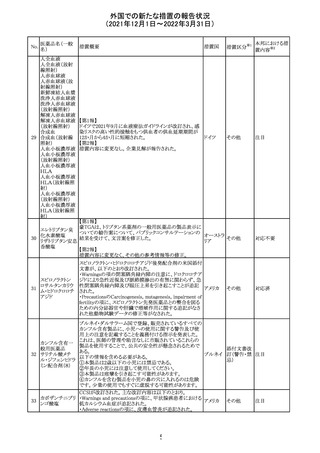
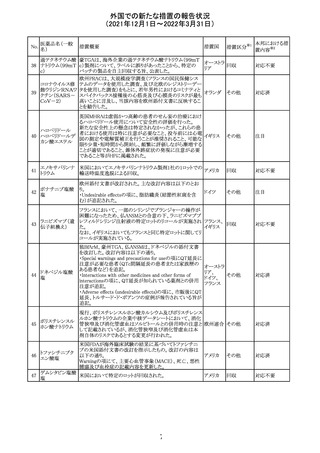
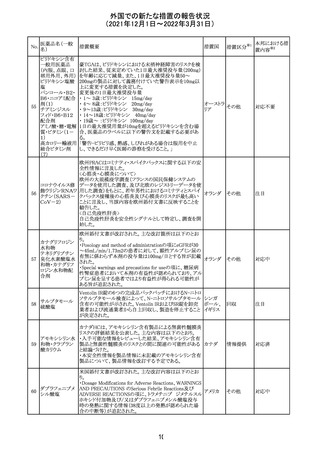
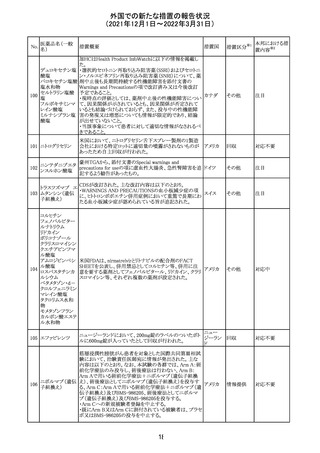
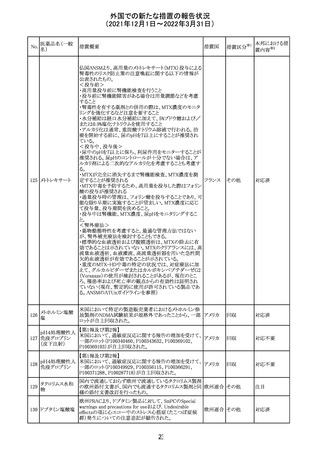
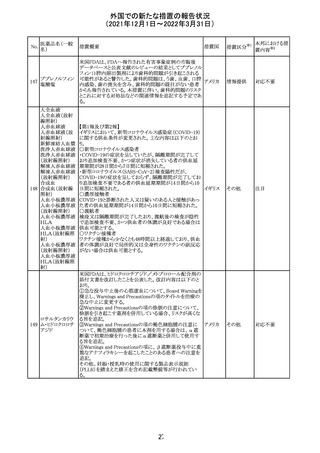
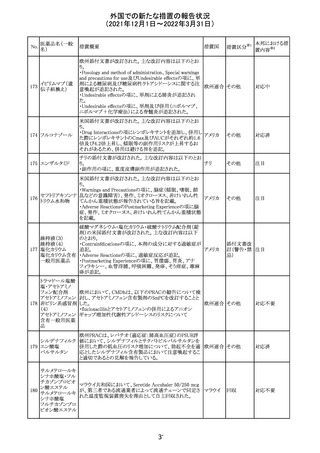
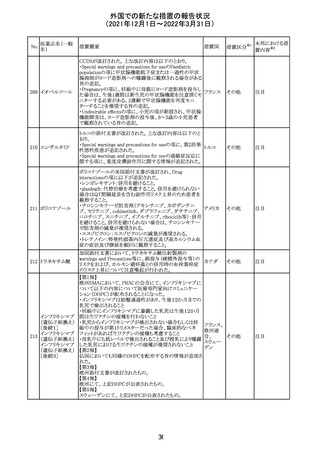
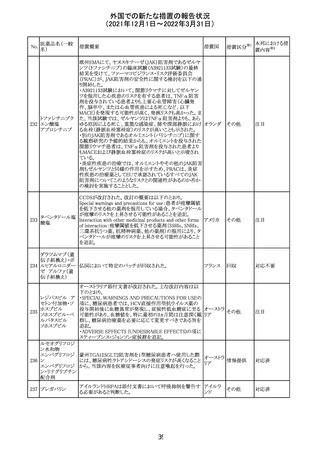
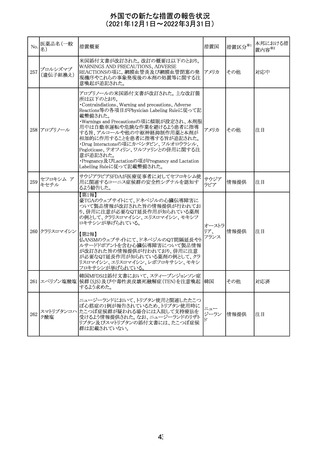
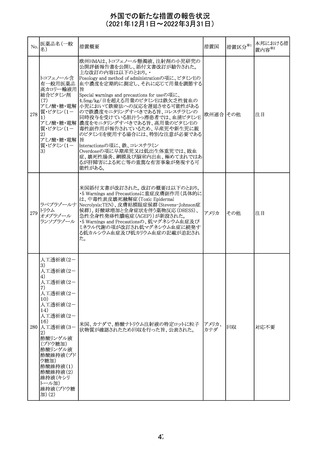
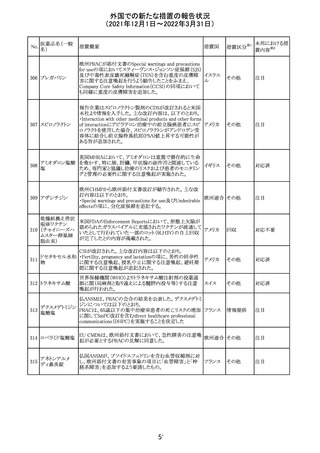
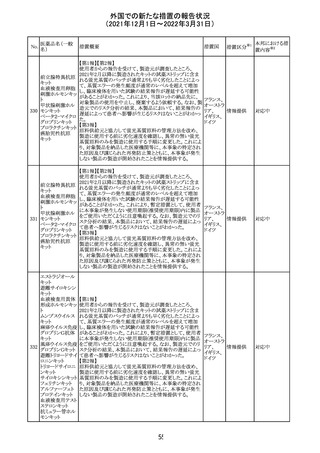
214 リファンピシン
措置概要
措置国
米国添付文書が改訂され、Warnings and Precautions及び
Adverse Reactionsの項に、肺毒性(間質性肺疾患、肺炎、
過敏性肺炎、好酸球性肺炎、肺浸潤、組織化肺炎、呼吸 アメリカ
不全、肺線維症、急性呼吸窮迫症候群を含むがこれらに
限定されない)が認められている旨が追記された。
措置区分
※1
本邦における措
置内容※2
その他
対応済
韓国
その他
対応不要
216 エンザルタミド
台湾の添付文書が改訂された。主な改訂内容は以下のと
おり。
・Special warnings and precautions for useの項に、第2原発
台湾
性悪性疾患が追記された。
・Special warnings and precautions for useの過敏症反応に
関する項に、重度皮膚副作用に関する情報が追記された。
その他
注目
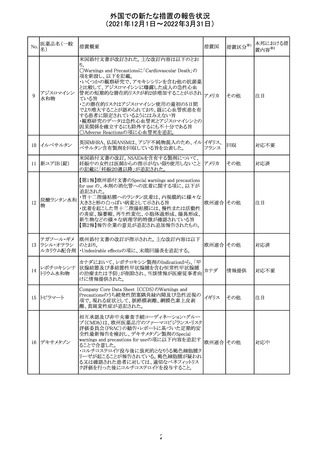
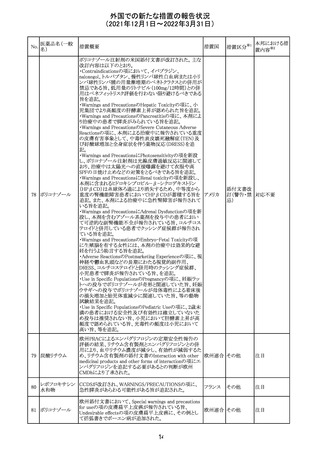
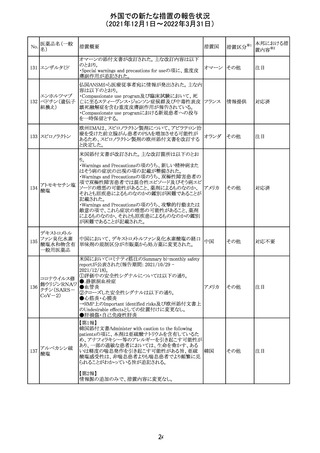
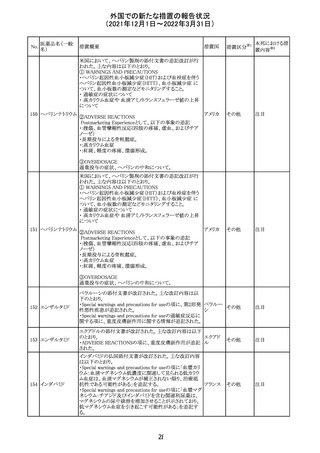
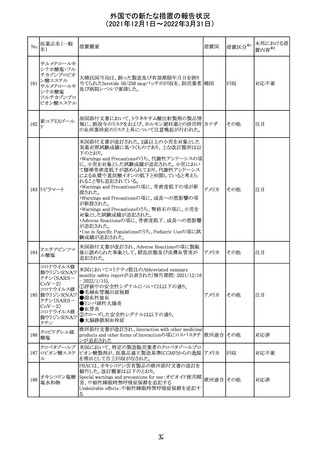
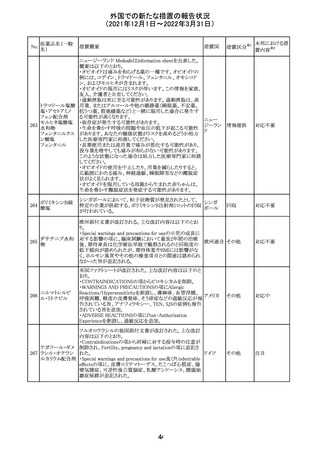
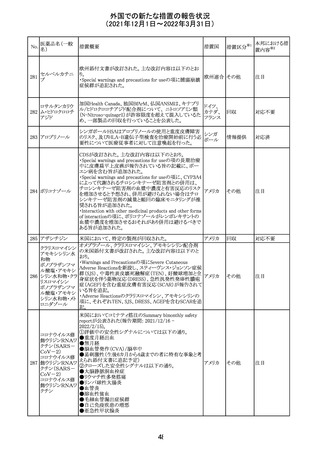
217 ケタミン塩酸塩
米国FDAは,医療専門家に対して,ケタミン含有製品の鼻
腔内投与についての警告をHPに掲載した。概要は以下の
とおり。
2019年に精神障害に対する治療薬としてS-ケタミン製剤を
承認したが,
・ S-ケタミンはラセミ体のケタミンに由来するものであるが,
同じ医薬品ではないこと
アメリカ
・FDAは,ケタミンを点鼻薬として一部の薬局が処方してい
ることを認識しており、ケタミンの経鼻投与による精神医学
的有害事象を5例把握していること
・ケタミンの点鼻薬製剤は承認していないこと
等により,妄想,解離,幻覚等の精神医学的有害事象の誘
発の発現リスクを含めて,ケタミンの鼻腔内投与の安全性
は確保されていない。
情報提供
対応不要
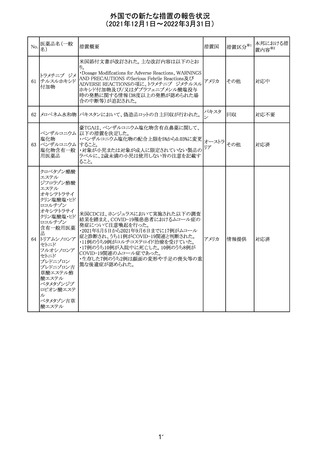
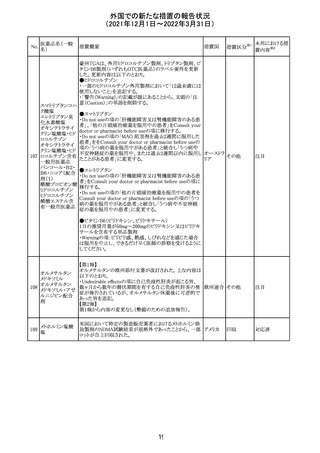
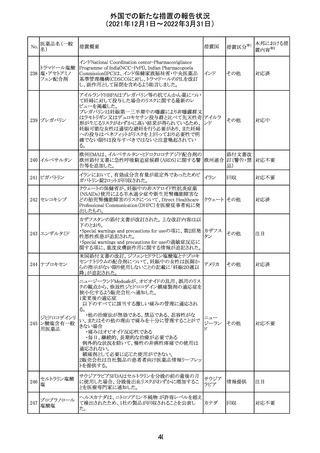
沈降精製百日せ 韓国MFDSは、KIDSによるレビューに基づいて、Boostrix
215 きジフテリア破傷 (Tdapワクチン)の製品情報にGuillain-Barre Syndrome
風混合ワクチン (GBS)のリスクを追記した。
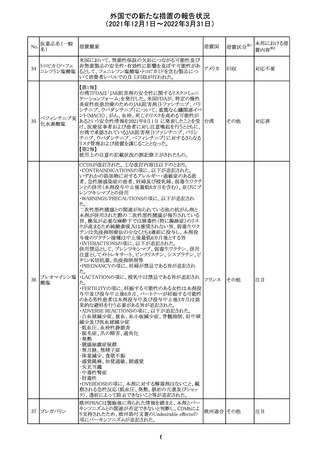
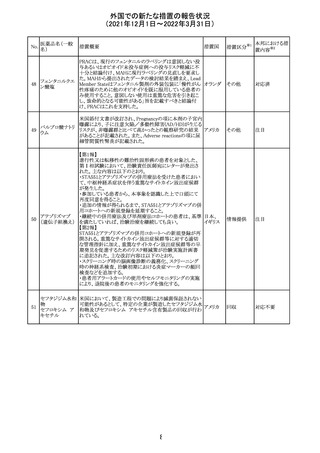
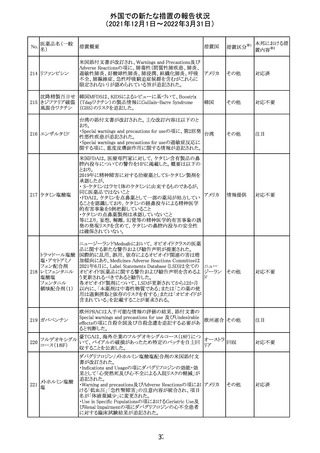
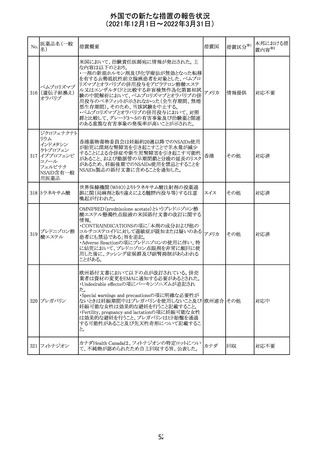
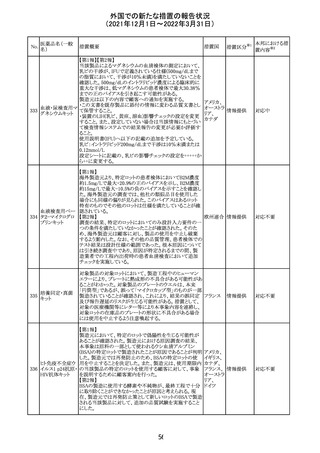
ニュージーランドMedsafeにおいて,オピオイドクラスの医薬
品に関する新たな警告および勧告声明が提案された。
トラマドール塩酸 国際的に乱用,誤用,依存によるオピオイド関連の害は増
塩・アセトアミノ
加傾向にあり、Medicines Adverse Reactions Committeeは
フェン配合剤
2021年6月に,Label Statements Database (LSD)は全ての ニュー
218 レミフェンタニル オピオイド医薬品に関する警告および勧告声明を含めるよ ジーラン その他
塩酸塩
う更新されるべきであると勧告した。
ド
フェンタニル
各オピオイド製剤について、LSDが更新されてから12か月
鎮咳配合剤(1) 以内に、「本薬剤は中毒性物質である」または「この薬の使
用は過剰摂取と依存のリスクを有する」または「オピオイドが
含まれている」を記載することが要求される。
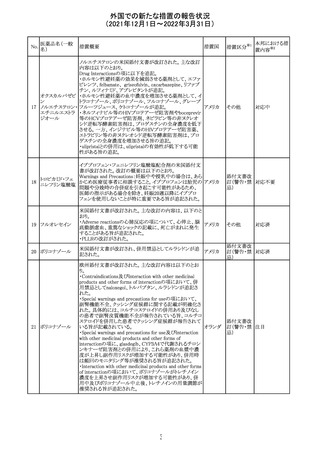
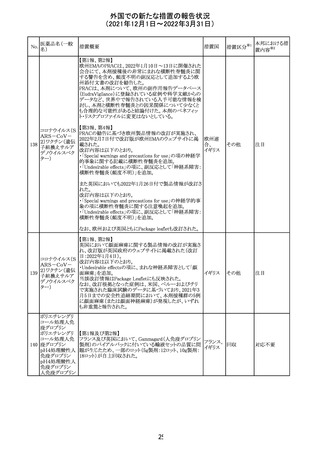
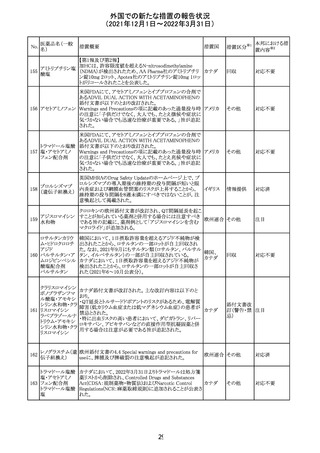
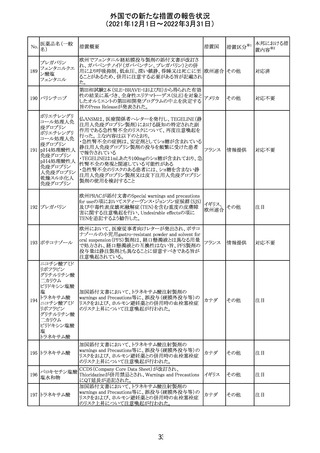
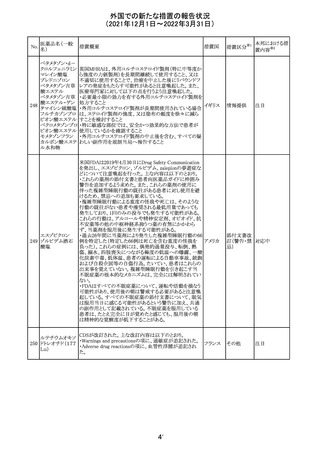
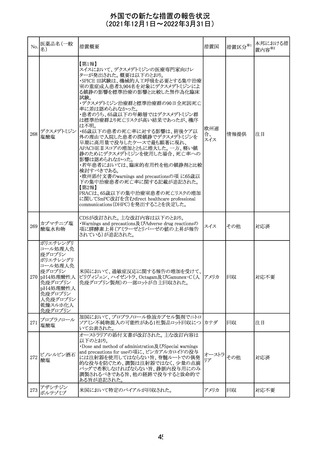
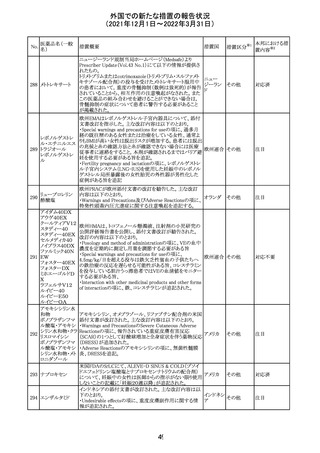
219 ガバペンチン
220
221
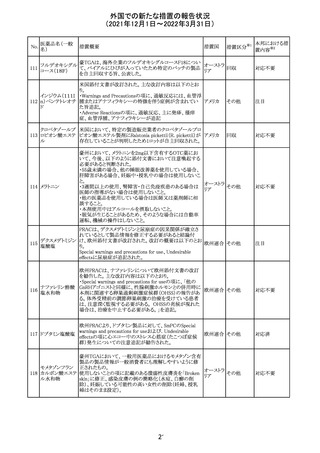
欧州PRACは入手可能な情報の評価の結果、添付文書の
Special warnings and precautions for use 及びUndesirable
欧州連合 その他
effectsの項に自殺企図及び自殺念慮を追記する必要があ
ると判断した。
豪TGAは、海外企業のフルデオキシグルコース(18F)につ
フルデオキシグル
オーストラ
いて、バイアルの破損があったため特定のバッチを自主回
回収
コース(18F)
リア
収することを公表した。
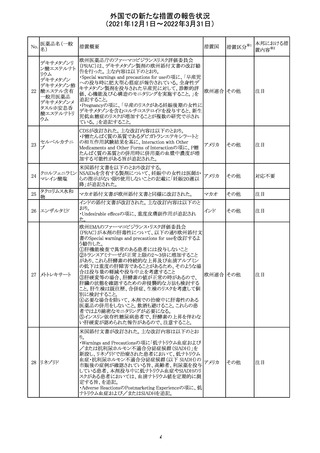
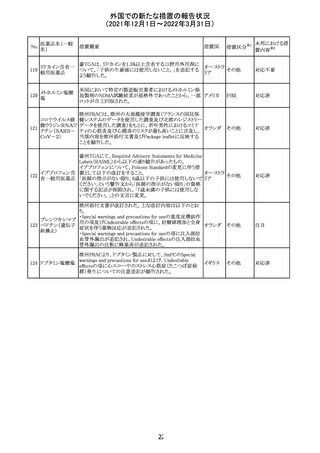
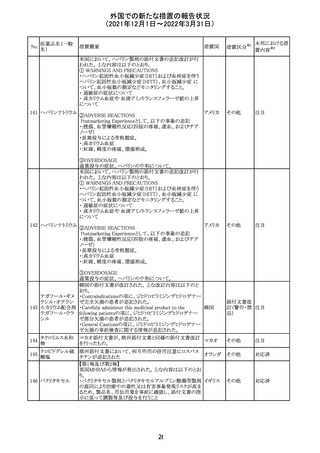
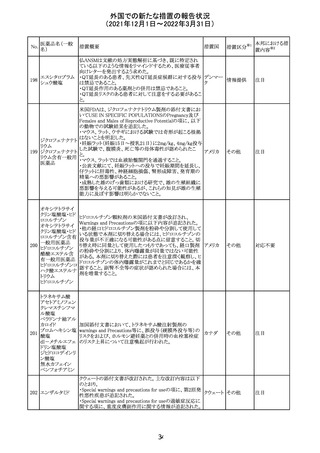
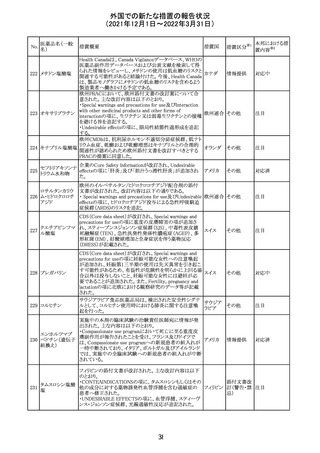
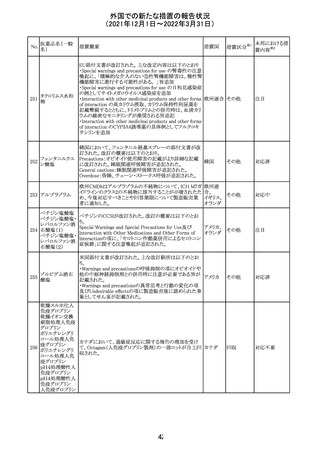
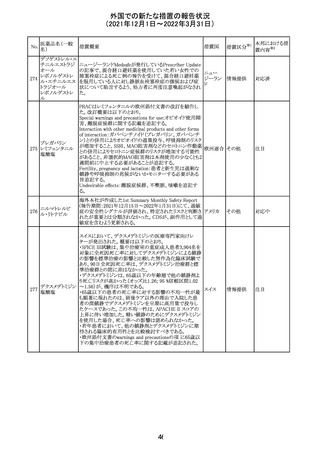
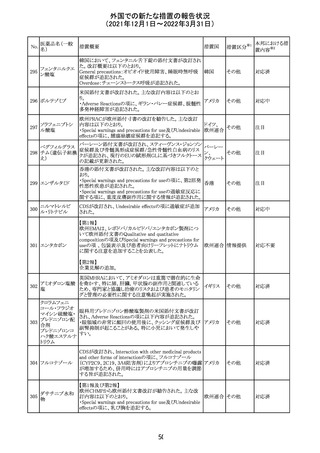
メトホルミン塩酸
塩
ダパグリフロジン/メトホルミン塩酸塩配合剤の米国添付文
書が改訂された。
・Indications and Usageの項にダパグリフロジンの効能・効
果として「心突然死及び心不全による入院リスクの軽減」が
追記された。
・Warning and precautions及びAdverse Reactionsの項にお アメリカ
ける「低血圧」「急性腎障害」の注意内容が統合され、項目
名が「体液量減少」に変更された。
・Use in Specific Populationsの項におけるGeriatric Use及
びRenal Impairmentの項にダパグリフロジンの心不全患者
に対する臨床試験結果が追記された。
37
その他
対応不要
注目
対応不要
対応済
(2021年12月1日~2022年3月31日)
No.
医薬品名(一般
名)
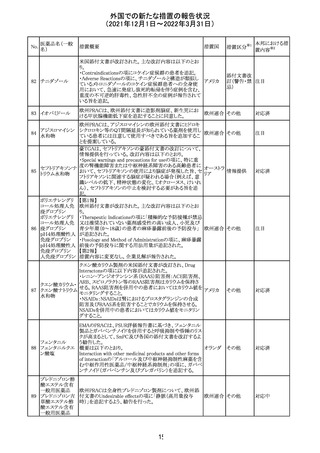
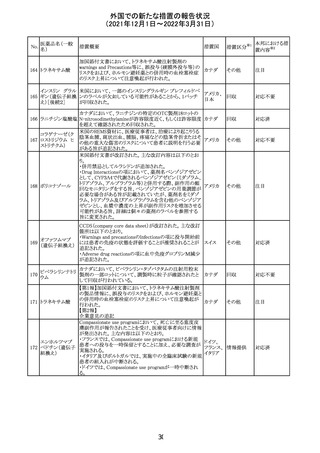
214 リファンピシン
措置概要
措置国
米国添付文書が改訂され、Warnings and Precautions及び
Adverse Reactionsの項に、肺毒性(間質性肺疾患、肺炎、
過敏性肺炎、好酸球性肺炎、肺浸潤、組織化肺炎、呼吸 アメリカ
不全、肺線維症、急性呼吸窮迫症候群を含むがこれらに
限定されない)が認められている旨が追記された。
措置区分
※1
本邦における措
置内容※2
その他
対応済
韓国
その他
対応不要
216 エンザルタミド
台湾の添付文書が改訂された。主な改訂内容は以下のと
おり。
・Special warnings and precautions for useの項に、第2原発
台湾
性悪性疾患が追記された。
・Special warnings and precautions for useの過敏症反応に
関する項に、重度皮膚副作用に関する情報が追記された。
その他
注目
217 ケタミン塩酸塩
米国FDAは,医療専門家に対して,ケタミン含有製品の鼻
腔内投与についての警告をHPに掲載した。概要は以下の
とおり。
2019年に精神障害に対する治療薬としてS-ケタミン製剤を
承認したが,
・ S-ケタミンはラセミ体のケタミンに由来するものであるが,
同じ医薬品ではないこと
アメリカ
・FDAは,ケタミンを点鼻薬として一部の薬局が処方してい
ることを認識しており、ケタミンの経鼻投与による精神医学
的有害事象を5例把握していること
・ケタミンの点鼻薬製剤は承認していないこと
等により,妄想,解離,幻覚等の精神医学的有害事象の誘
発の発現リスクを含めて,ケタミンの鼻腔内投与の安全性
は確保されていない。
情報提供
対応不要
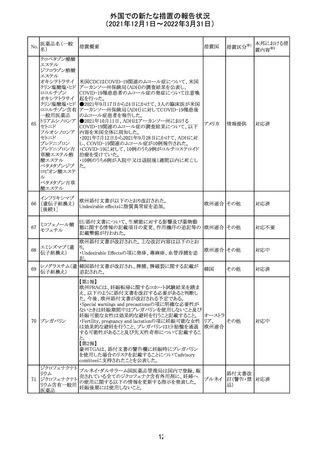
沈降精製百日せ 韓国MFDSは、KIDSによるレビューに基づいて、Boostrix
215 きジフテリア破傷 (Tdapワクチン)の製品情報にGuillain-Barre Syndrome
風混合ワクチン (GBS)のリスクを追記した。
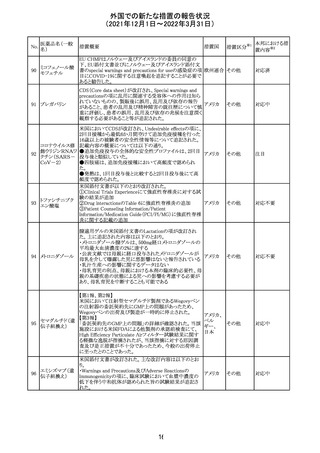
ニュージーランドMedsafeにおいて,オピオイドクラスの医薬
品に関する新たな警告および勧告声明が提案された。
トラマドール塩酸 国際的に乱用,誤用,依存によるオピオイド関連の害は増
塩・アセトアミノ
加傾向にあり、Medicines Adverse Reactions Committeeは
フェン配合剤
2021年6月に,Label Statements Database (LSD)は全ての ニュー
218 レミフェンタニル オピオイド医薬品に関する警告および勧告声明を含めるよ ジーラン その他
塩酸塩
う更新されるべきであると勧告した。
ド
フェンタニル
各オピオイド製剤について、LSDが更新されてから12か月
鎮咳配合剤(1) 以内に、「本薬剤は中毒性物質である」または「この薬の使
用は過剰摂取と依存のリスクを有する」または「オピオイドが
含まれている」を記載することが要求される。
219 ガバペンチン
220
221
欧州PRACは入手可能な情報の評価の結果、添付文書の
Special warnings and precautions for use 及びUndesirable
欧州連合 その他
effectsの項に自殺企図及び自殺念慮を追記する必要があ
ると判断した。
豪TGAは、海外企業のフルデオキシグルコース(18F)につ
フルデオキシグル
オーストラ
いて、バイアルの破損があったため特定のバッチを自主回
回収
コース(18F)
リア
収することを公表した。
メトホルミン塩酸
塩
ダパグリフロジン/メトホルミン塩酸塩配合剤の米国添付文
書が改訂された。
・Indications and Usageの項にダパグリフロジンの効能・効
果として「心突然死及び心不全による入院リスクの軽減」が
追記された。
・Warning and precautions及びAdverse Reactionsの項にお アメリカ
ける「低血圧」「急性腎障害」の注意内容が統合され、項目
名が「体液量減少」に変更された。
・Use in Specific Populationsの項におけるGeriatric Use及
びRenal Impairmentの項にダパグリフロジンの心不全患者
に対する臨床試験結果が追記された。
37
その他
対応不要
注目
対応不要
対応済