よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
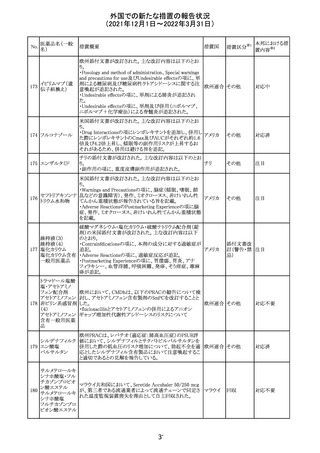
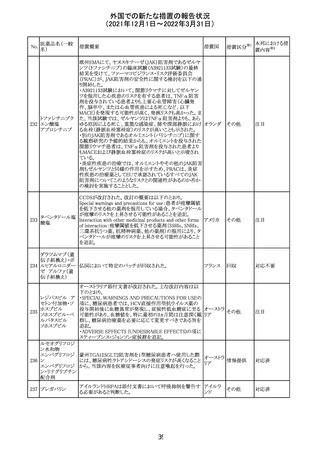
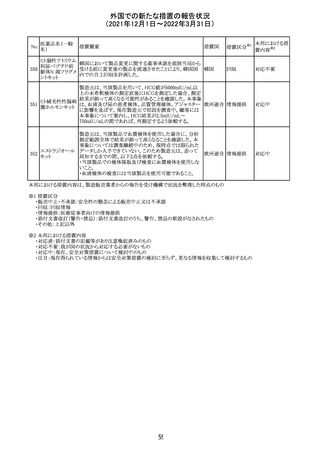
外国での新たな措置の報告状況
(2021年12月1日~2022年3月31日)
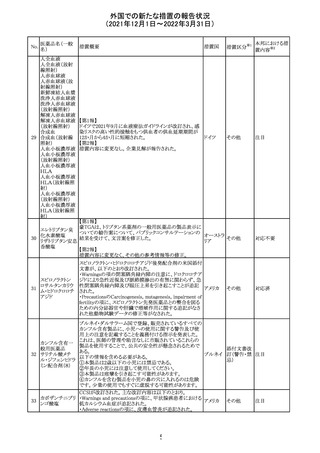
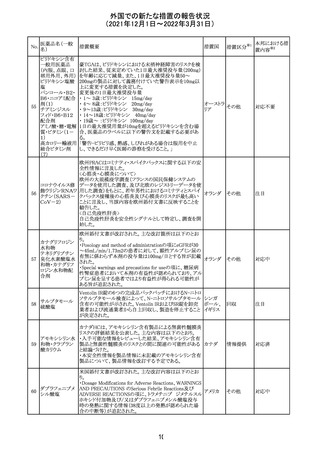
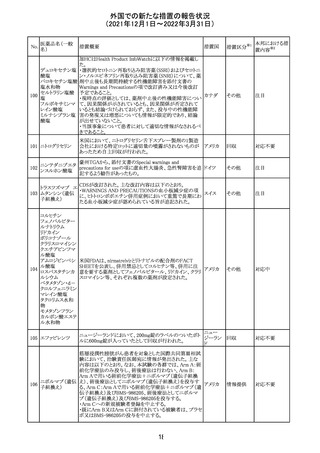
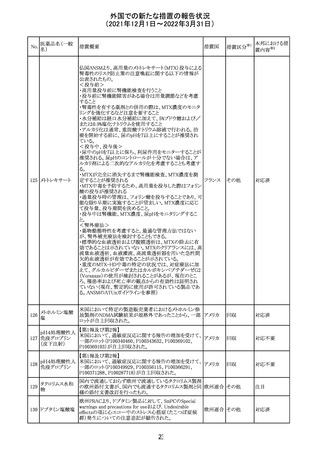
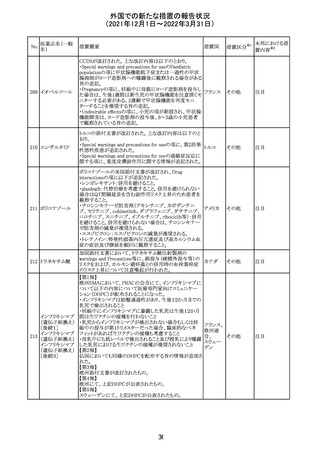
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
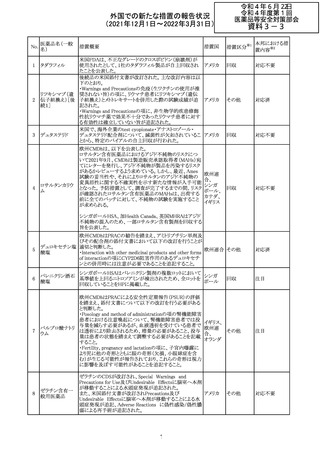
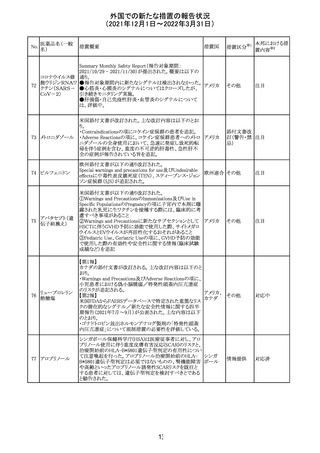
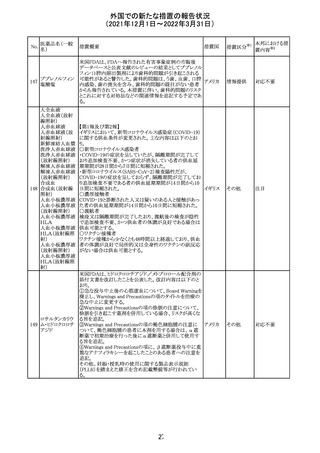
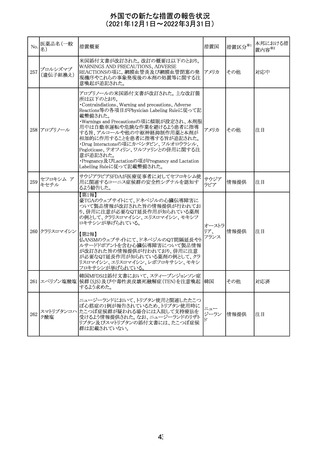
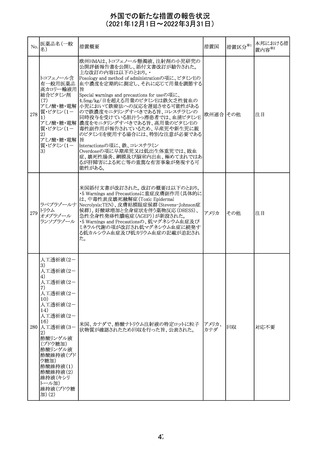
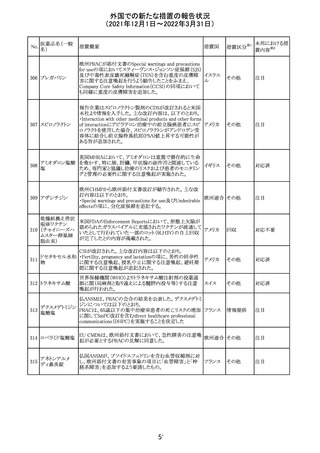
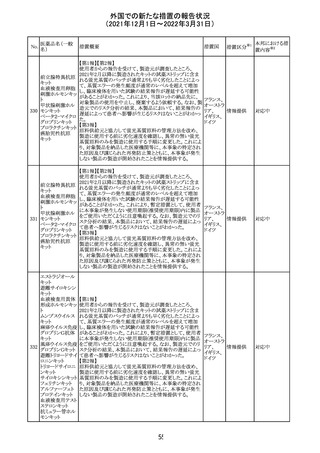
Health Canadaは、Canada Vigilanceデータベース、WHOの
医薬品副作用データベースおよび公表文献を検索して得
られた情報をレビューし、メサドンの使用は低血糖のリスクと
222 メサドン塩酸塩
カナダ
情報提供
関連する可能性があると結論付けた。今後、Health Canada
は、製品モノグラフにメサドンの低血糖のリスクを含めるよう
製造業者へ働きかける予定である。
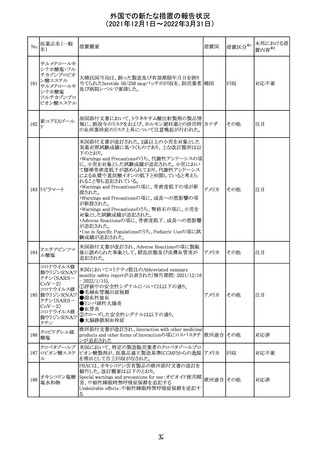
欧州PRACにおいて、欧州添付文書の改訂案について合
意された。主な改訂内容は以下のとおり。
・Special warnings and precautions for use及びInteraction
with other medicinal products and other forms of
223 オキサリプラチン
欧州連合 その他
interactionの項に、生ワクチン又は弱毒生ワクチンとの接種
を避ける旨を追記する。
・Undesirable effectsの項に、限局性結節性過形成を追記
する。
欧州CMDhは、抗利尿ホルモン不適切分泌症候群、低ナト
リウム血症、乾癬および乾癬増悪はキナプリルとの合理的
224 キナプリル塩酸塩
オランダ その他
関連性が認められため欧州添付文書を改訂すべきとする
PRACの提案に同意した。
225
企業のCore Safety Informationが改訂され、Undesirable
セフトリアキソンナ
effectsの項に「肝炎」及び「胆汁うっ滞性肝炎」が追加され
トリウム水和物
た。
アメリカ
その他
※1
本邦における措
置内容※2
対応中
注目
注目
対応済
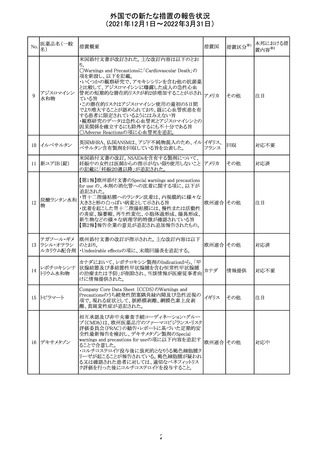
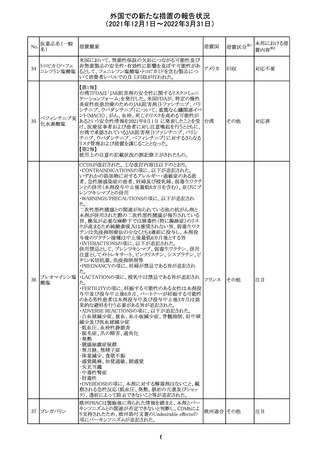
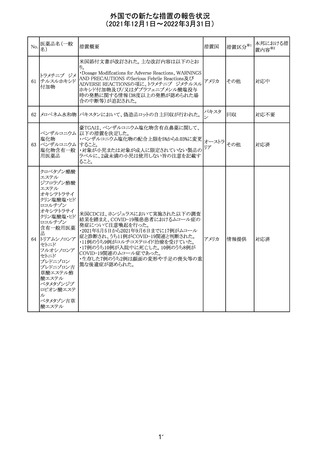
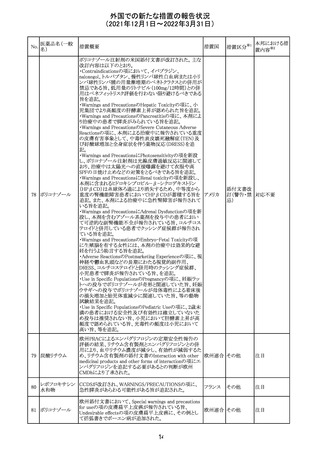
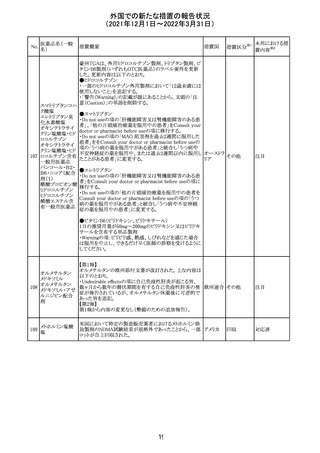
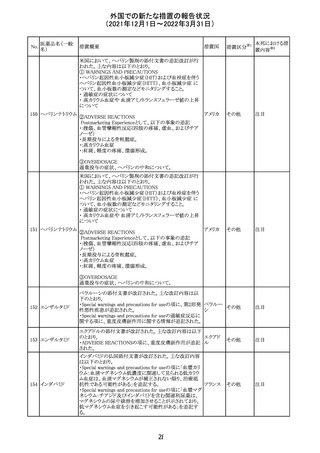
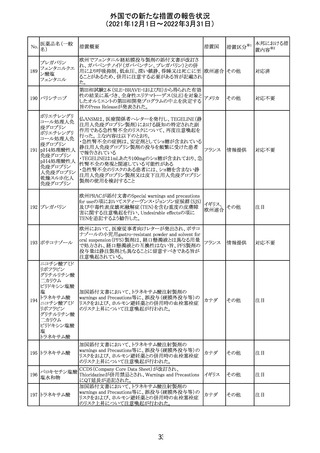
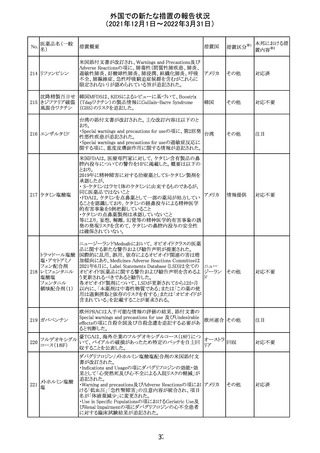
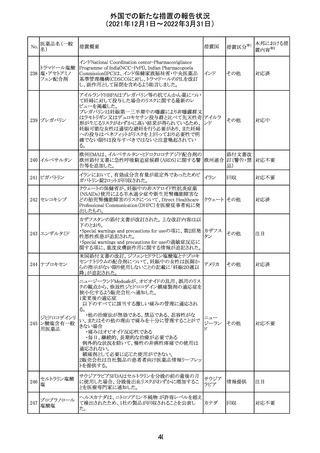
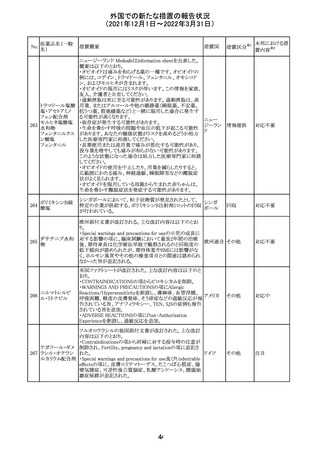
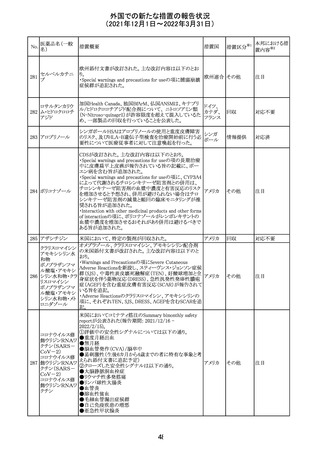
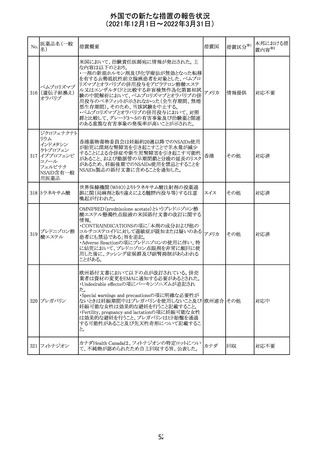
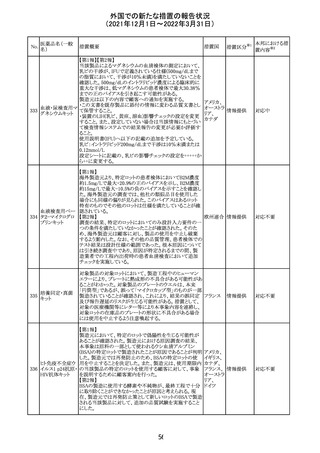
欧州のイルベサルタン/ヒドロクロロチアジド配合剤の添付
ロサルタンカリウ 文書が改訂された。改訂内容は以下の通りである。
226 ム・ヒドロクロロチ ・ Special warnings and precautions for use及びUndesirable 欧州連合 その他
アジド
effectsの項に、ヒドロクロチアジド投与による急性呼吸窮迫
症候群(ARDS)のリスクを追記。
注目
CDS(Core data sheet)が改訂され、Special warnings and
precautions for useの項に重度の皮膚障害の項が追加さ
クエチアピンフマ れ、スティーブンスジョンソン症候群(SJS)、中毒性表皮壊
227
ル酸塩
死融解症(TEN)、急性汎発性発疹性膿疱症(AGEP)、多
形紅斑(EM)、好酸球増加と全身症状を伴う薬物反応
(DRESS)が記載された。
注目
228 プレガバリン
229 コルヒチン
スイス
その他
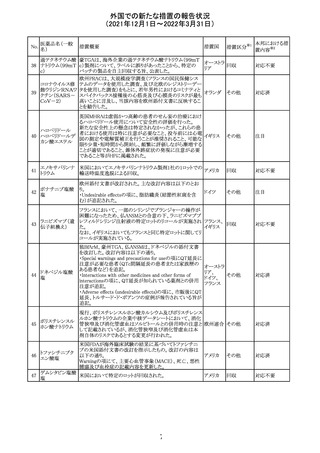
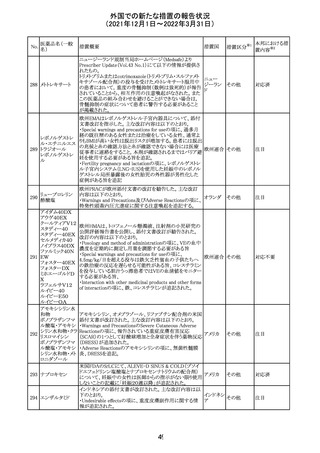
CDS(Core data sheet)が改訂され、Special warnings and
precautions for useの項に妊娠可能な女性への注意喚起
が追加され、妊娠第1三半期の使用は先天異常を引き起こ
す可能性があるため、有益性が危険性を明らかに上回る場
スイス
その他
合以外は投与しないこと、妊娠可能な女性には避妊が必
要であることが追加された。また、Fertility, pregnancy and
lactationの項に北欧における観察研究のデータ等が記載
された。
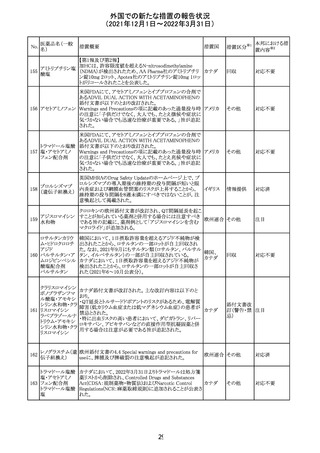
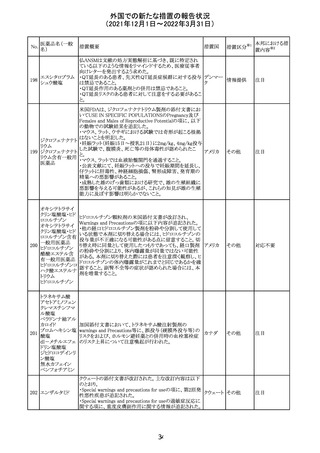
サウジアラビア食品医薬品局は、検出された安全性シグナ
サウジア
ルとして、コルヒチン使用時における肺炎に関する注意喚
その他
ラビア
起を行った。
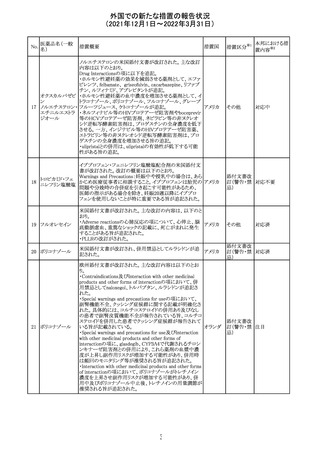
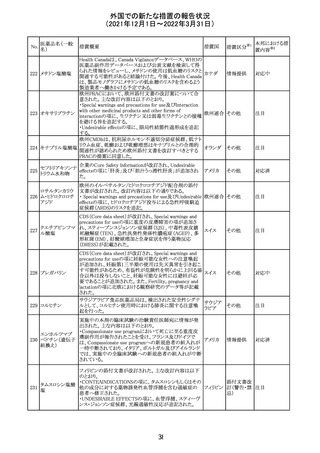
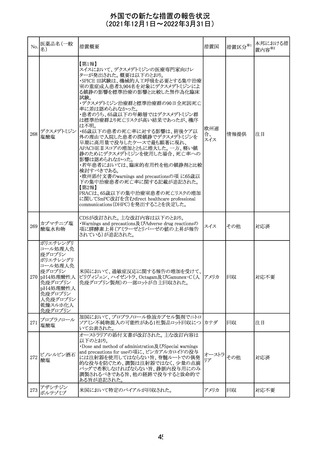
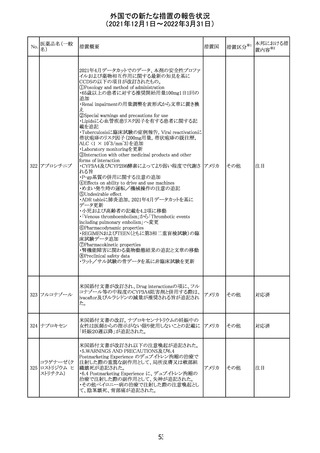
実施中の本剤の臨床試験の治験責任医師宛に情報が発
出された。主な内容は以下のとおり。
・Compassionate use programにおいて死亡に至る重度皮
エンホルツマブ
膚副作用が報告されたことを受け、フランス及びドイツで
230 ベドチン(遺伝子
アメリカ
は、Compassionate use programへの新規患者の組入れが
組換え)
一時中断されており、イタリア、ポルトガル及びアイルランド
では、実施中の全臨床試験への新規患者の組入れが中断
されている。
情報提供
対応中
注目
対応済
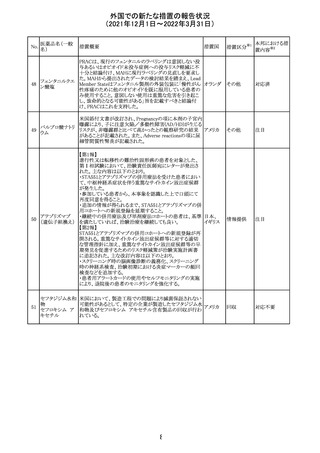
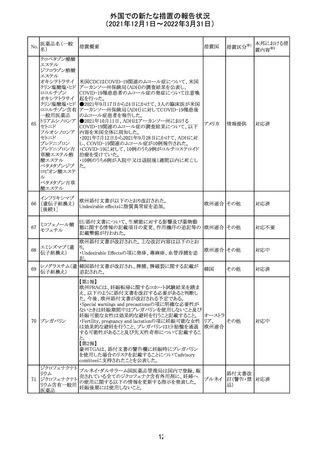
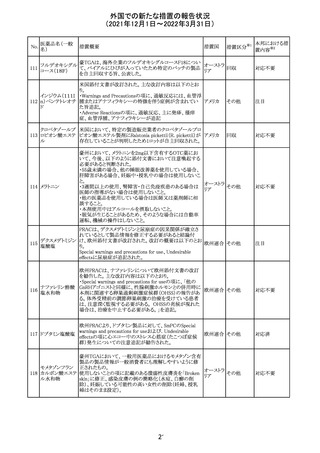
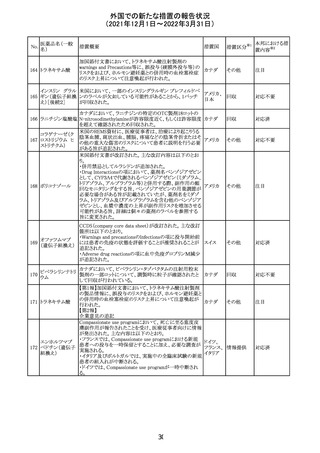
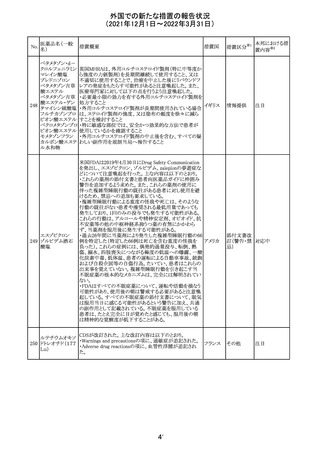
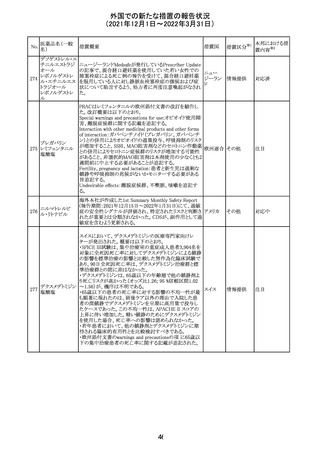
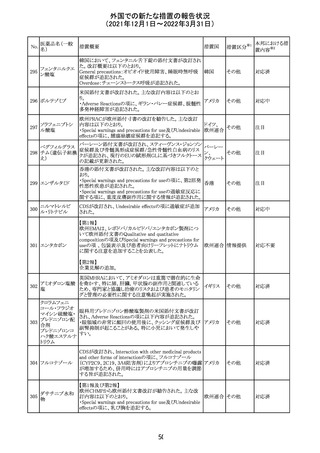
フィリピンの添付文書が改訂された。主な改訂内容は以下
のとおり。
・CONTEAINDICATIONSの項に、タムスロシンもしくはその
添付文書改
タムスロシン塩酸
231
他の成分に対する薬物誘発性血管浮腫を含む過敏症の フィリピン 訂(警告・禁 注目
塩
患者へ修正された。
忌)
・UNDESIRABLE EFFECTSの項に、血管浮腫、スティーヴ
ンス・ジョンソン症候群、光線過敏性反応が追記された。
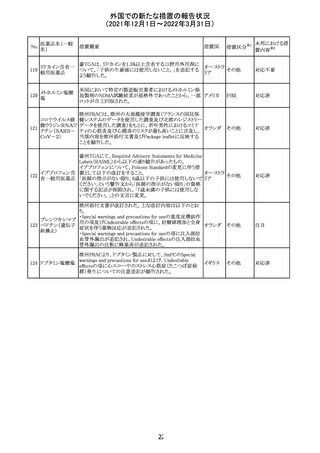
38
(2021年12月1日~2022年3月31日)
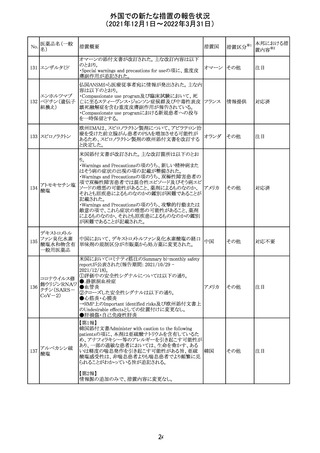
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
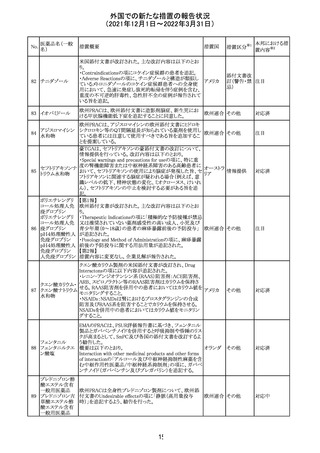
Health Canadaは、Canada Vigilanceデータベース、WHOの
医薬品副作用データベースおよび公表文献を検索して得
られた情報をレビューし、メサドンの使用は低血糖のリスクと
222 メサドン塩酸塩
カナダ
情報提供
関連する可能性があると結論付けた。今後、Health Canada
は、製品モノグラフにメサドンの低血糖のリスクを含めるよう
製造業者へ働きかける予定である。
欧州PRACにおいて、欧州添付文書の改訂案について合
意された。主な改訂内容は以下のとおり。
・Special warnings and precautions for use及びInteraction
with other medicinal products and other forms of
223 オキサリプラチン
欧州連合 その他
interactionの項に、生ワクチン又は弱毒生ワクチンとの接種
を避ける旨を追記する。
・Undesirable effectsの項に、限局性結節性過形成を追記
する。
欧州CMDhは、抗利尿ホルモン不適切分泌症候群、低ナト
リウム血症、乾癬および乾癬増悪はキナプリルとの合理的
224 キナプリル塩酸塩
オランダ その他
関連性が認められため欧州添付文書を改訂すべきとする
PRACの提案に同意した。
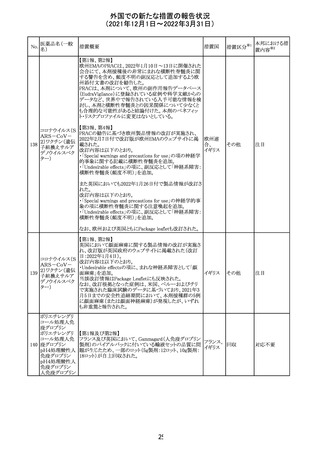
225
企業のCore Safety Informationが改訂され、Undesirable
セフトリアキソンナ
effectsの項に「肝炎」及び「胆汁うっ滞性肝炎」が追加され
トリウム水和物
た。
アメリカ
その他
※1
本邦における措
置内容※2
対応中
注目
注目
対応済
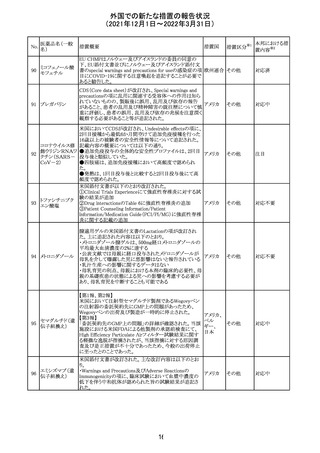
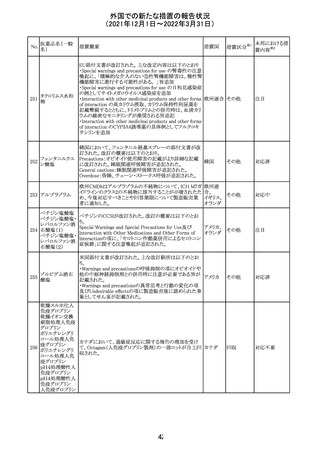
欧州のイルベサルタン/ヒドロクロロチアジド配合剤の添付
ロサルタンカリウ 文書が改訂された。改訂内容は以下の通りである。
226 ム・ヒドロクロロチ ・ Special warnings and precautions for use及びUndesirable 欧州連合 その他
アジド
effectsの項に、ヒドロクロチアジド投与による急性呼吸窮迫
症候群(ARDS)のリスクを追記。
注目
CDS(Core data sheet)が改訂され、Special warnings and
precautions for useの項に重度の皮膚障害の項が追加さ
クエチアピンフマ れ、スティーブンスジョンソン症候群(SJS)、中毒性表皮壊
227
ル酸塩
死融解症(TEN)、急性汎発性発疹性膿疱症(AGEP)、多
形紅斑(EM)、好酸球増加と全身症状を伴う薬物反応
(DRESS)が記載された。
注目
228 プレガバリン
229 コルヒチン
スイス
その他
CDS(Core data sheet)が改訂され、Special warnings and
precautions for useの項に妊娠可能な女性への注意喚起
が追加され、妊娠第1三半期の使用は先天異常を引き起こ
す可能性があるため、有益性が危険性を明らかに上回る場
スイス
その他
合以外は投与しないこと、妊娠可能な女性には避妊が必
要であることが追加された。また、Fertility, pregnancy and
lactationの項に北欧における観察研究のデータ等が記載
された。
サウジアラビア食品医薬品局は、検出された安全性シグナ
サウジア
ルとして、コルヒチン使用時における肺炎に関する注意喚
その他
ラビア
起を行った。
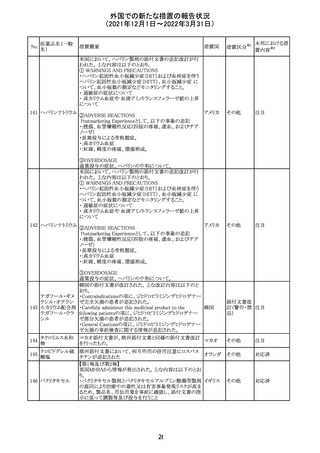
実施中の本剤の臨床試験の治験責任医師宛に情報が発
出された。主な内容は以下のとおり。
・Compassionate use programにおいて死亡に至る重度皮
エンホルツマブ
膚副作用が報告されたことを受け、フランス及びドイツで
230 ベドチン(遺伝子
アメリカ
は、Compassionate use programへの新規患者の組入れが
組換え)
一時中断されており、イタリア、ポルトガル及びアイルランド
では、実施中の全臨床試験への新規患者の組入れが中断
されている。
情報提供
対応中
注目
対応済
フィリピンの添付文書が改訂された。主な改訂内容は以下
のとおり。
・CONTEAINDICATIONSの項に、タムスロシンもしくはその
添付文書改
タムスロシン塩酸
231
他の成分に対する薬物誘発性血管浮腫を含む過敏症の フィリピン 訂(警告・禁 注目
塩
患者へ修正された。
忌)
・UNDESIRABLE EFFECTSの項に、血管浮腫、スティーヴ
ンス・ジョンソン症候群、光線過敏性反応が追記された。
38