よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
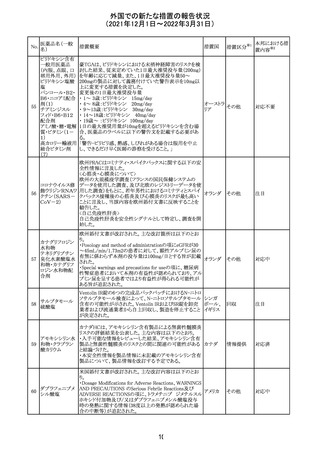
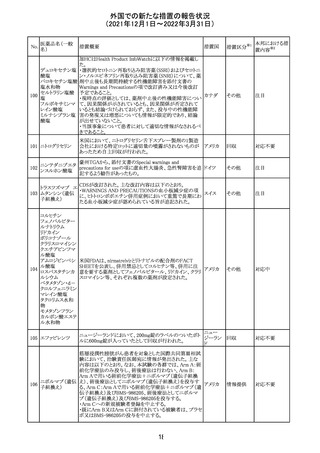
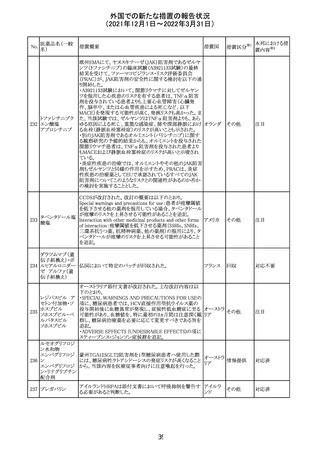
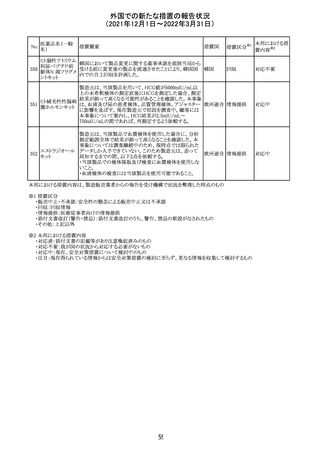
外国での新たな措置の報告状況
(2021年12月1日~2022年3月31日)
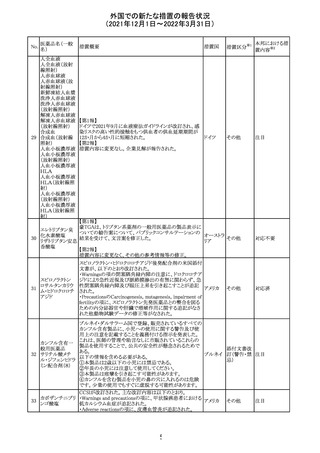
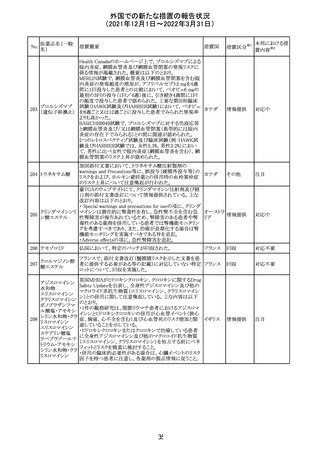
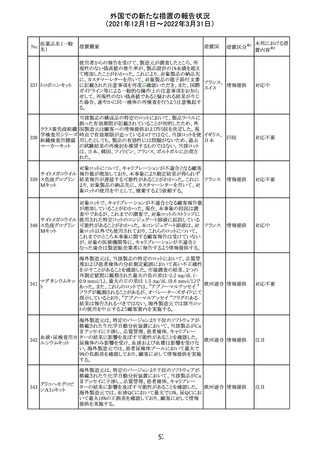
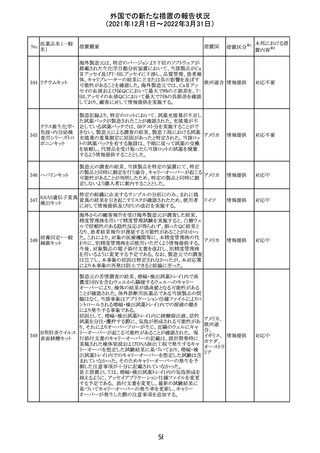
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
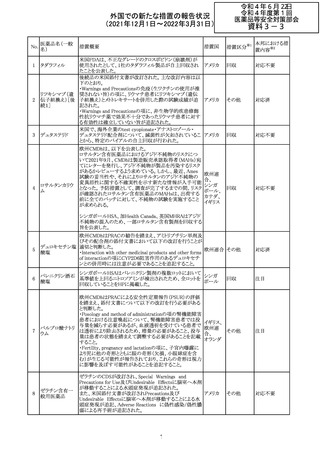
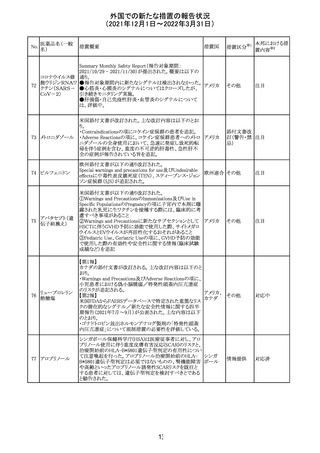
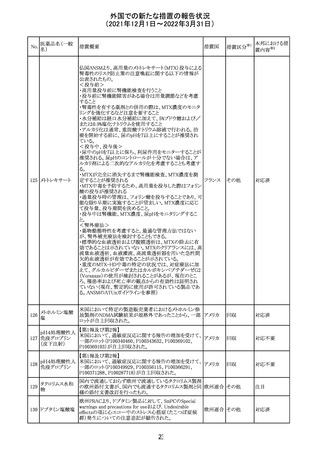
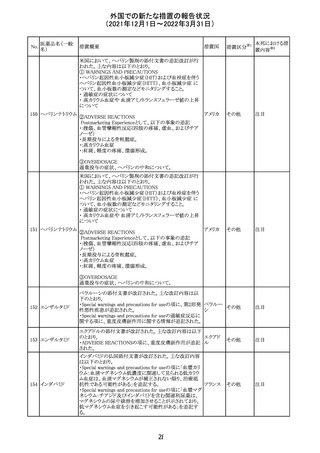
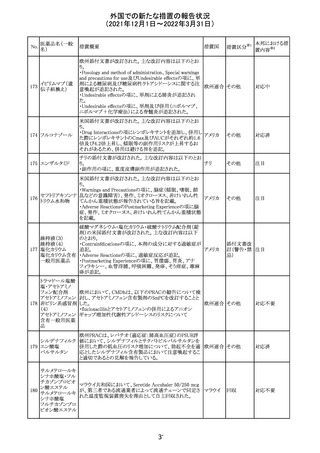
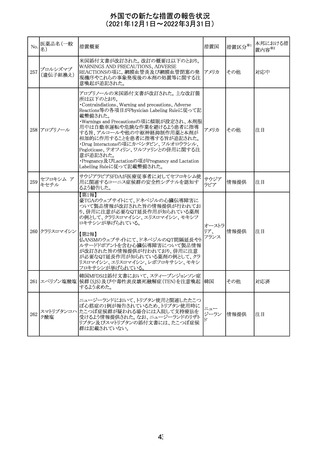
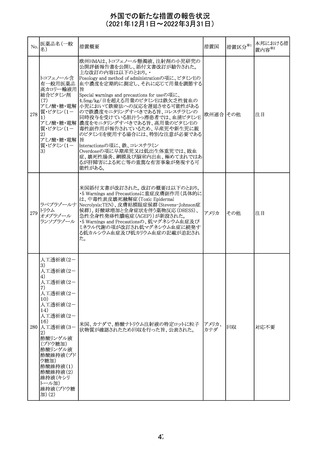
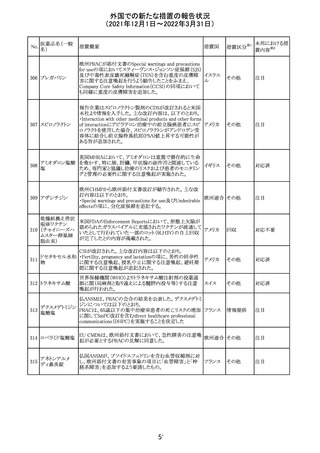
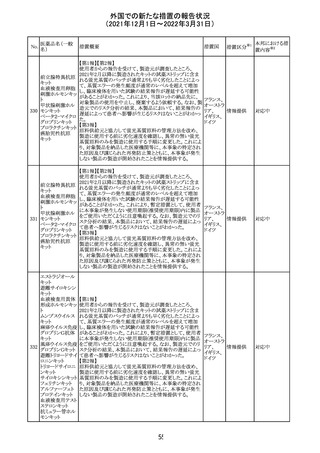
CCDSが改訂された。主な改訂内容は以下のとおり。
・Posology and method of administrationの項:
偶然に塗布部位の皮膚に接触することで、他者やペットに
エストラジオールが移行し悪影響を及ぼす可能性があるた
め、塗布時や塗布後の
予防措置(手洗い、衣服で覆う等)を追記。
・Special warnings and precautions for useの項:
-外因性エストロゲンは、遺伝性および後天性血管性浮腫
の症状を誘発または悪化させる可能性がある旨を追記
-ALT上昇:エチニルエストラジオール(EE)含有製剤と
フィンラン
97 エストラジオール ombitasvir/paritaprevir/リトナビルを併用した女性でALT
その他
ド
上昇が認められた。EE以外のエストロゲン含有製剤を使用
中の女性ではエストロゲン非投与女性と同程度のALT上昇
率であったが、EE以外のエストロゲン投与女性は限られて
いるため併用には注意が必要、またグレカプレビル/ピブ
レンタスビルの併用も同様である旨の追記。
・Interaction with other medicinal products and other forms
of interactionの項:
ombitasvir/paritaprevir/リトナビル、あるいはグレンカプ
レビル/ピブレンタスビルとの併用療法では注意が必要の
旨追記。
98
イリノテカン塩酸
塩水和物
99 ポビドンヨード
※1
本邦における措
置内容※2
注目
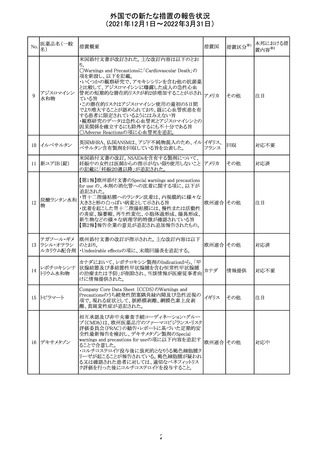
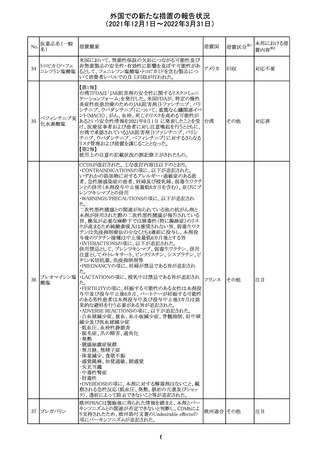
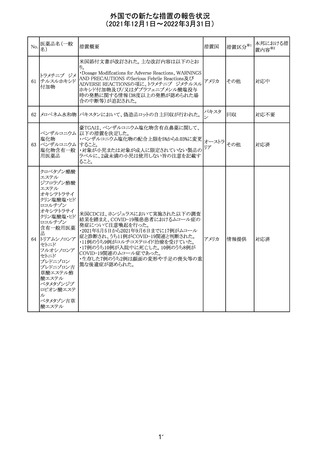
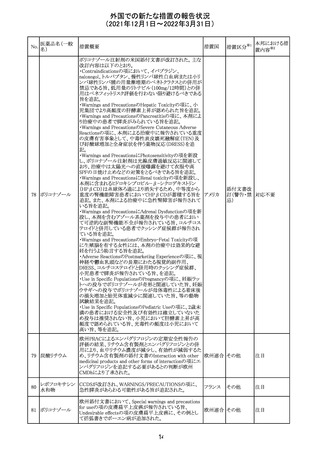
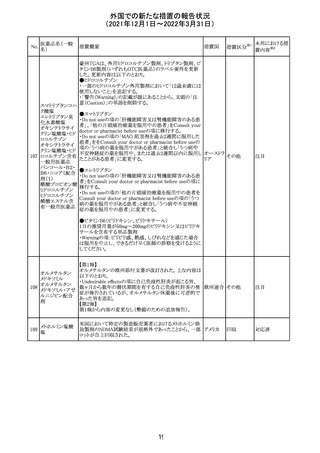
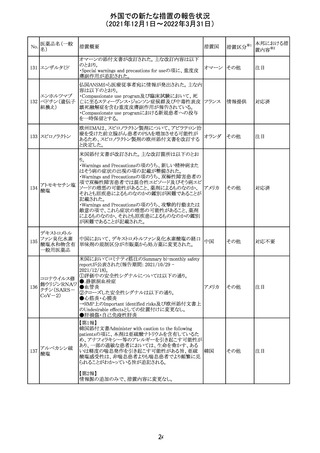
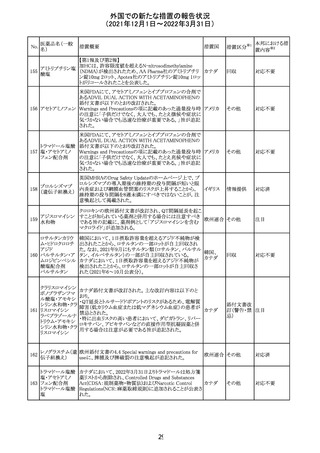
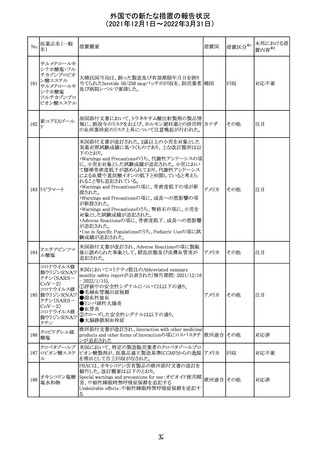
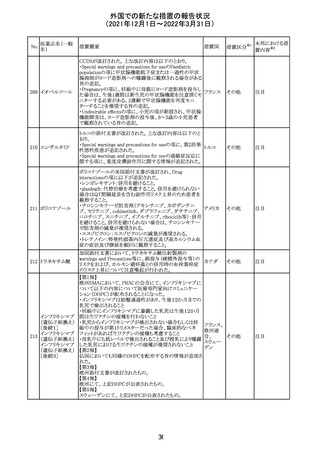
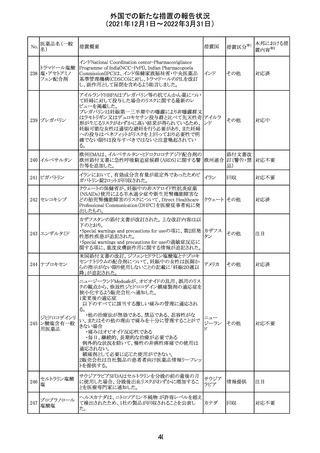
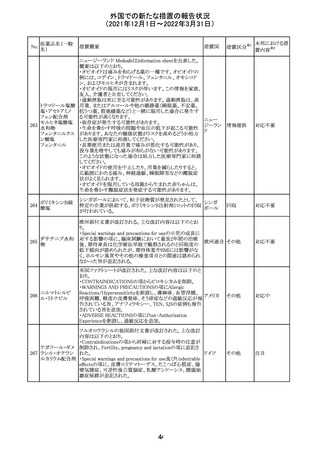
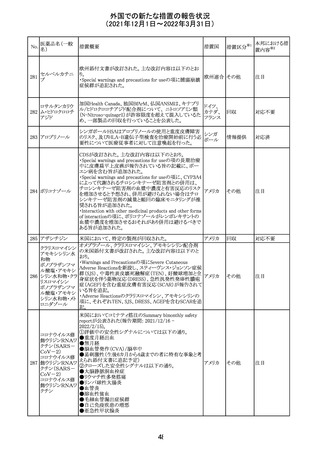
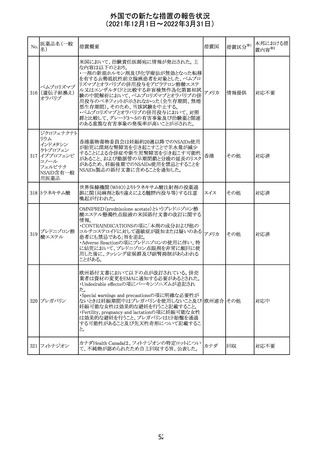
【第1報】
独国BfArMから、医療従事者宛にレターが発出された。ま
た、独国添付文書(「警告と使用上の注意」及び「薬物動態
学的特性」の項)が改訂される。主な内容は以下のとおり。
・重篤な好中球減少症および下痢のリスクが高い患者の特
定するために、UGT1A1遺伝子型判定は有用である。
・UGT1A1の低活性型の患者(例:ジルベール症候群のよう
なUGT1A1*28または*6変異体のホモ接合体)では、重
篤な好中球減少症および下痢のリスクが増加する。これら
のリスクはイリノテカン投与量とともに増加する。
・UGT1A1活性が低下した患者におけるイリノテカン開始用 ドイツ、
量の減量を検討する必要がある。
アメリカ
・忍容性に応じて、増量が可能である。
【第2報及び第3報】
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・DOSAGE AND ADMINISTRATION及びWARNINGS
AND PRECAUTIONSの項にUGT1A1の低活性型の患者に
対する注意喚起(UGT1A1*6のホモ接合体、UGT1A1*28
及びUGT1A1*6のヘテロ接合体をもつ患者に対する開始
用量の減量の検討、UGT1A1活性が低下した患者のおけ
る好中球減少症のリスク増加等)が追記された。
情報提供
対応済
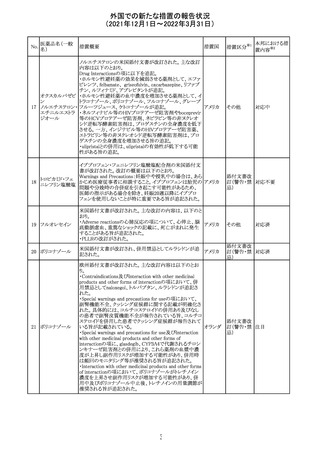
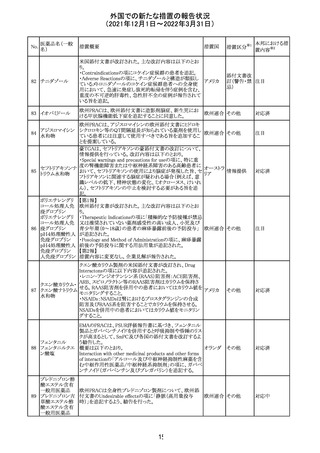
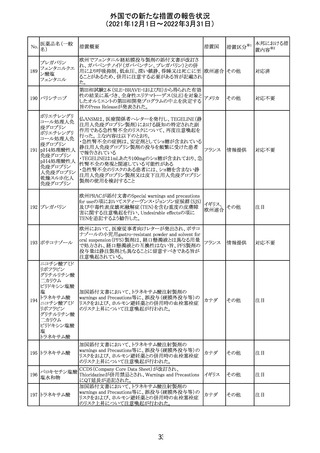
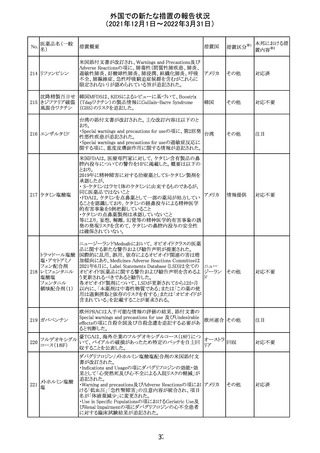
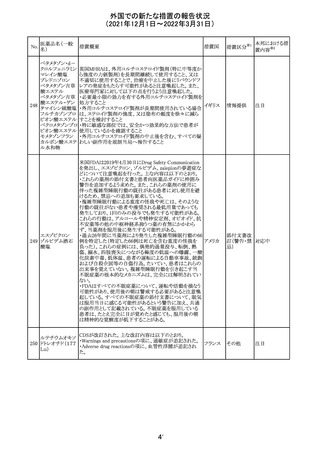
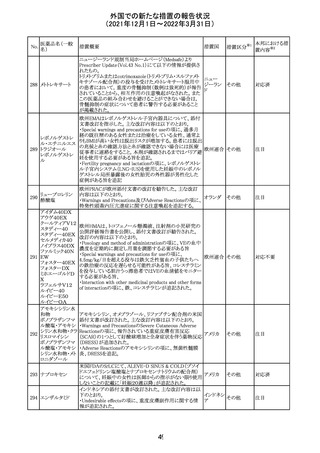
CCDSが改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項において、「放射性ヨードシンチグラ
フィまたは甲状腺癌の放射性ヨウ素治療の実施前あるいは
実施中の使用」が設定され、ポビドンヨード曝露と放射性ヨ
ウ素投与の間隔は少なくとも1-2週間あける旨が記載されて
いたが、「放射性ヨウ素の投与前、投与中及び投与後」に
整備。
・Interaction with other medicinal products and other forms アメリカ
of interaction.の項において、本剤による治療終了後、新た
なシンチグラフィーまでに4週間あけるべきである旨を追
記。
・局所及び膣投与製剤について、Special warnings and
precautions for useの項において、ポビドンヨードの使用が
塗布部位での一時的な皮膚変色につながる可能性がある
旨、Undesirable effectsの項に皮膚変色を追記。
その他
注目
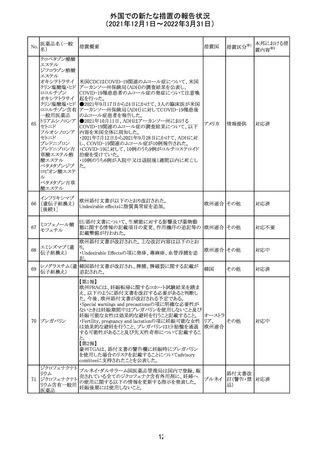
17
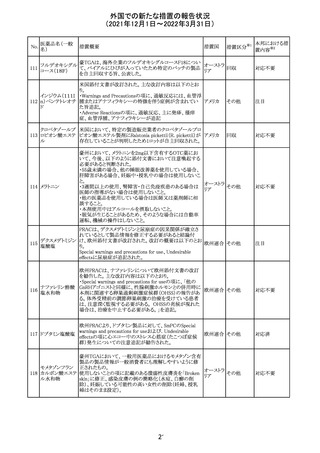
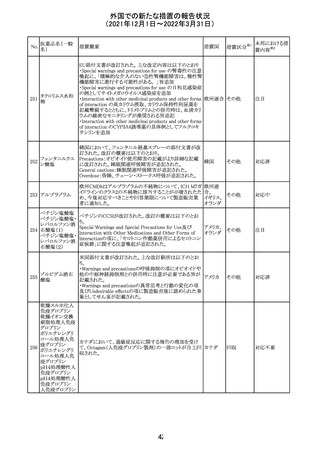
(2021年12月1日~2022年3月31日)
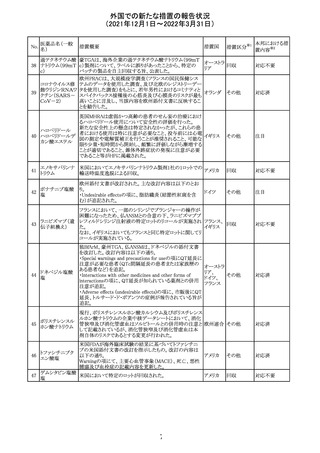
No.
医薬品名(一般
名)
措置概要
措置国
措置区分
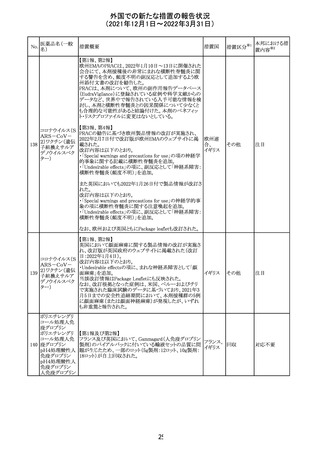
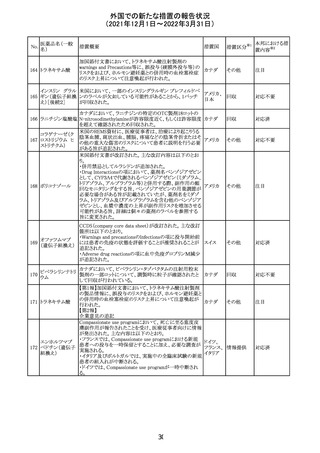
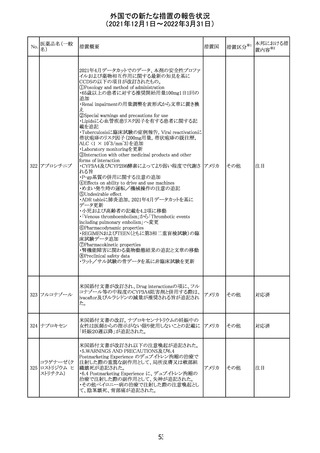
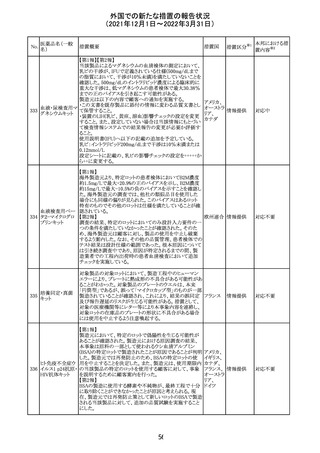
CCDSが改訂された。主な改訂内容は以下のとおり。
・Posology and method of administrationの項:
偶然に塗布部位の皮膚に接触することで、他者やペットに
エストラジオールが移行し悪影響を及ぼす可能性があるた
め、塗布時や塗布後の
予防措置(手洗い、衣服で覆う等)を追記。
・Special warnings and precautions for useの項:
-外因性エストロゲンは、遺伝性および後天性血管性浮腫
の症状を誘発または悪化させる可能性がある旨を追記
-ALT上昇:エチニルエストラジオール(EE)含有製剤と
フィンラン
97 エストラジオール ombitasvir/paritaprevir/リトナビルを併用した女性でALT
その他
ド
上昇が認められた。EE以外のエストロゲン含有製剤を使用
中の女性ではエストロゲン非投与女性と同程度のALT上昇
率であったが、EE以外のエストロゲン投与女性は限られて
いるため併用には注意が必要、またグレカプレビル/ピブ
レンタスビルの併用も同様である旨の追記。
・Interaction with other medicinal products and other forms
of interactionの項:
ombitasvir/paritaprevir/リトナビル、あるいはグレンカプ
レビル/ピブレンタスビルとの併用療法では注意が必要の
旨追記。
98
イリノテカン塩酸
塩水和物
99 ポビドンヨード
※1
本邦における措
置内容※2
注目
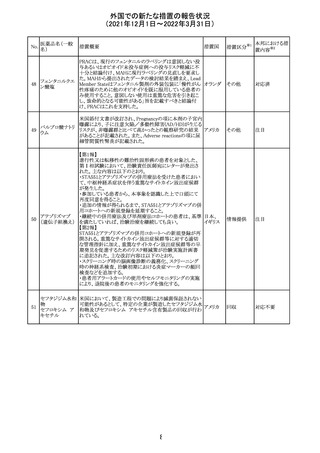
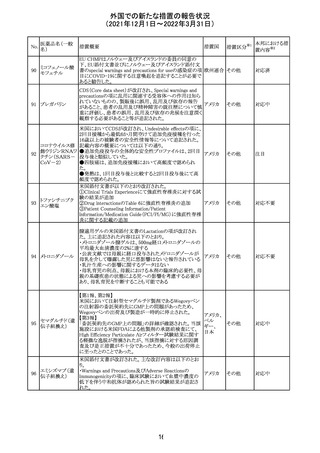
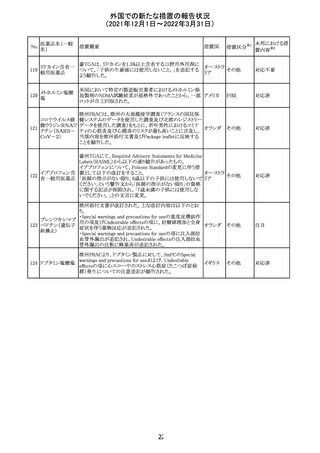
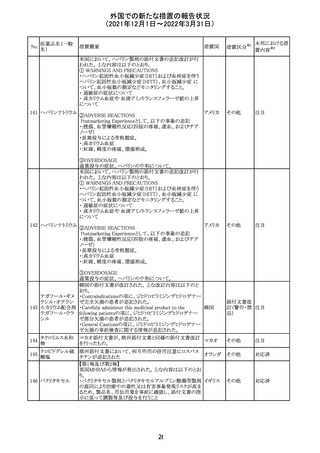
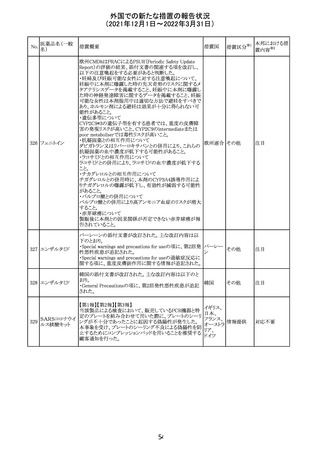
【第1報】
独国BfArMから、医療従事者宛にレターが発出された。ま
た、独国添付文書(「警告と使用上の注意」及び「薬物動態
学的特性」の項)が改訂される。主な内容は以下のとおり。
・重篤な好中球減少症および下痢のリスクが高い患者の特
定するために、UGT1A1遺伝子型判定は有用である。
・UGT1A1の低活性型の患者(例:ジルベール症候群のよう
なUGT1A1*28または*6変異体のホモ接合体)では、重
篤な好中球減少症および下痢のリスクが増加する。これら
のリスクはイリノテカン投与量とともに増加する。
・UGT1A1活性が低下した患者におけるイリノテカン開始用 ドイツ、
量の減量を検討する必要がある。
アメリカ
・忍容性に応じて、増量が可能である。
【第2報及び第3報】
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・DOSAGE AND ADMINISTRATION及びWARNINGS
AND PRECAUTIONSの項にUGT1A1の低活性型の患者に
対する注意喚起(UGT1A1*6のホモ接合体、UGT1A1*28
及びUGT1A1*6のヘテロ接合体をもつ患者に対する開始
用量の減量の検討、UGT1A1活性が低下した患者のおけ
る好中球減少症のリスク増加等)が追記された。
情報提供
対応済
CCDSが改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項において、「放射性ヨードシンチグラ
フィまたは甲状腺癌の放射性ヨウ素治療の実施前あるいは
実施中の使用」が設定され、ポビドンヨード曝露と放射性ヨ
ウ素投与の間隔は少なくとも1-2週間あける旨が記載されて
いたが、「放射性ヨウ素の投与前、投与中及び投与後」に
整備。
・Interaction with other medicinal products and other forms アメリカ
of interaction.の項において、本剤による治療終了後、新た
なシンチグラフィーまでに4週間あけるべきである旨を追
記。
・局所及び膣投与製剤について、Special warnings and
precautions for useの項において、ポビドンヨードの使用が
塗布部位での一時的な皮膚変色につながる可能性がある
旨、Undesirable effectsの項に皮膚変色を追記。
その他
注目
17