よむ、つかう、まなぶ。
総ー6-1最適使用推進ガイドラインについて[562KB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64494.html |
| 出典情報 | 中央社会保険医療協議会 総会(第620回 10/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
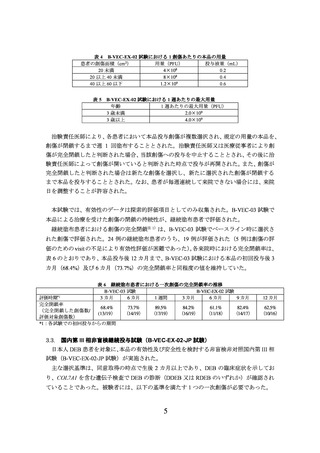
表 4 B-VEC-EX-02 試験における 1 創傷あたりの本品の用量
患者の創傷面積(cm2)
用量(PFU)
投与液量(mL)
20 未満
4×108
0.2
20 以上 40 未満
8×108
0.4
40 以上 60 以下
1.2×109
0.6
表5
B-VEC-EX-02 試験における 1 週あたりの最大用量
年齢
1 週あたりの最大用量(PFU)
3 歳未満
2.0×109
3 歳以上
4.0×109
治験責任医師により、各患者において本品投与創傷が複数選択され、規定の用量の本品を、
創傷が閉鎖するまで週 1 回塗布することとされた。治験責任医師又は医療従事者により創
傷が完全閉鎖したと判断された場合、当該創傷への投与を中止することとされ、その後に治
験責任医師によって創傷が開いていると判断された時点で投与が再開された。また、創傷が
完全閉鎖したと判断された場合は新たな創傷を選択し、新たに選択された創傷が閉鎖する
まで本品を投与することとされた。なお、患者が毎週連続して来院できない場合には、来院
日を調整することが許容された。
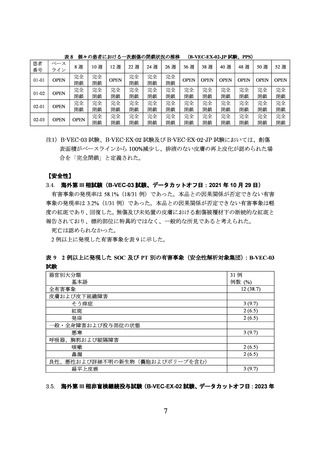
本試験では、有効性のデータは探索的評価項目としてのみ収集された。B-VEC-03 試験で
本品による治療を受けた創傷の閉鎖の持続性が、継続塗布患者で評価された。
継続塗布患者における創傷の完全閉鎖注 1)は、B-VEC-03 試験でベースライン時に選択さ
れた創傷で評価された。24 例の継続塗布患者のうち、19 例が評価された(5 例は創傷の評
価のための visit の不足により有効性評価が困難であった)。各来院時における完全閉鎖率は、
表 6 のとおりであり、本品投与後 12 カ月まで、B-VEC-03 試験における本品の初回投与後 3
カ月(68.4%)及び 6 カ月(73.7%)の完全閉鎖率と同程度の値を維持していた。
表 6 継続塗布患者における一次創傷の完全閉鎖率の推移
B-VEC-03 試験
B-VEC-EX-02 試験
3 カ月
6 カ月
1 週間
3 カ月
6 カ月
9 カ月
評価時期*1
完全閉鎖率
68.4%
(完全閉鎖した創傷数/
(13/19)
評価対象創傷数)
*1:各試験での初回投与からの期間
3.3.
73.7%
(14/19)
89.5%
(17/19)
84.2%
(16/19)
61.1%
(11/18)
82.4%
(14/17)
12 カ月
62.5%
(10/16)
国内第 III 相非盲検継続投与試験(B-VEC-EX-02-JP 試験)
日本人 DEB 患者を対象に、
本品の有効性及び安全性を検討する非盲検非対照国内第 III 相
試験(B-VEC-EX-02-JP 試験)が実施された。
主な選択基準は、同意取得の時点で生後 2 カ月以上であり、DEB の臨床症状を示してお
り、COL7A1 を含む遺伝子検査で DEB の診断(DDEB 又は RDEB のいずれか)が確認され
ていることであった。被験者には、以下の基準を満たす 1 つの一次創傷が必要であった。
5
患者の創傷面積(cm2)
用量(PFU)
投与液量(mL)
20 未満
4×108
0.2
20 以上 40 未満
8×108
0.4
40 以上 60 以下
1.2×109
0.6
表5
B-VEC-EX-02 試験における 1 週あたりの最大用量
年齢
1 週あたりの最大用量(PFU)
3 歳未満
2.0×109
3 歳以上
4.0×109
治験責任医師により、各患者において本品投与創傷が複数選択され、規定の用量の本品を、
創傷が閉鎖するまで週 1 回塗布することとされた。治験責任医師又は医療従事者により創
傷が完全閉鎖したと判断された場合、当該創傷への投与を中止することとされ、その後に治
験責任医師によって創傷が開いていると判断された時点で投与が再開された。また、創傷が
完全閉鎖したと判断された場合は新たな創傷を選択し、新たに選択された創傷が閉鎖する
まで本品を投与することとされた。なお、患者が毎週連続して来院できない場合には、来院
日を調整することが許容された。
本試験では、有効性のデータは探索的評価項目としてのみ収集された。B-VEC-03 試験で
本品による治療を受けた創傷の閉鎖の持続性が、継続塗布患者で評価された。
継続塗布患者における創傷の完全閉鎖注 1)は、B-VEC-03 試験でベースライン時に選択さ
れた創傷で評価された。24 例の継続塗布患者のうち、19 例が評価された(5 例は創傷の評
価のための visit の不足により有効性評価が困難であった)。各来院時における完全閉鎖率は、
表 6 のとおりであり、本品投与後 12 カ月まで、B-VEC-03 試験における本品の初回投与後 3
カ月(68.4%)及び 6 カ月(73.7%)の完全閉鎖率と同程度の値を維持していた。
表 6 継続塗布患者における一次創傷の完全閉鎖率の推移
B-VEC-03 試験
B-VEC-EX-02 試験
3 カ月
6 カ月
1 週間
3 カ月
6 カ月
9 カ月
評価時期*1
完全閉鎖率
68.4%
(完全閉鎖した創傷数/
(13/19)
評価対象創傷数)
*1:各試験での初回投与からの期間
3.3.
73.7%
(14/19)
89.5%
(17/19)
84.2%
(16/19)
61.1%
(11/18)
82.4%
(14/17)
12 カ月
62.5%
(10/16)
国内第 III 相非盲検継続投与試験(B-VEC-EX-02-JP 試験)
日本人 DEB 患者を対象に、
本品の有効性及び安全性を検討する非盲検非対照国内第 III 相
試験(B-VEC-EX-02-JP 試験)が実施された。
主な選択基準は、同意取得の時点で生後 2 カ月以上であり、DEB の臨床症状を示してお
り、COL7A1 を含む遺伝子検査で DEB の診断(DDEB 又は RDEB のいずれか)が確認され
ていることであった。被験者には、以下の基準を満たす 1 つの一次創傷が必要であった。
5