よむ、つかう、まなぶ。
総ー6-1最適使用推進ガイドラインについて[562KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64494.html |
| 出典情報 | 中央社会保険医療協議会 総会(第620回 10/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
表1
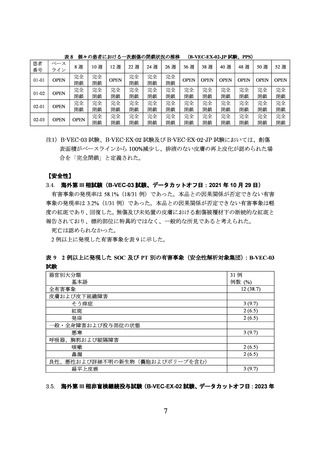
B-VEC-03 試験における 1 創傷あたりの本品の用量
患者の創傷面積(cm2)
用量(PFU)
20 未満
4×108
20 以上 40 未満
8×108
40 以上 60 以下
1.2×109
表2
B-VEC-03 試験における 1 週あたりの最大用量
年齢
1 週あたりの最大用量(PFU)
6 カ月以上 3 歳未満
1.6×109
3 歳以上 6 歳未満
2.4×109
6 歳以上
3.2×109
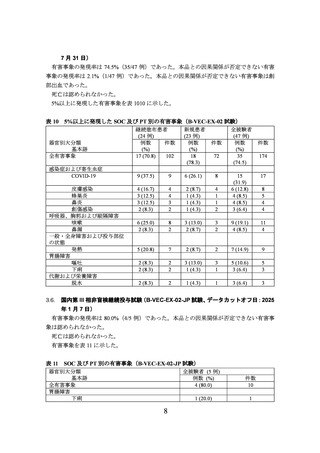
ITT 集団(N=31)において、主要評価項目である初回投与 6 カ月後の創傷の完全治癒(22
及び 24 週目又は 24 及び 26 週目の 2 回の visit で連続しての完全閉鎖注 1))率は、表 3 のと
おりであり、両群間に統計学的な有意差が認められた。
表 3 治験製品の初回投与後 6 カ月における完全治癒した一次創傷の割合(B-VEC-03 試験、ITT 集団)
本品投与創傷
プラセボ投与創傷
群間差[95%CI]
(31 例)
(31 例)
両側 p 値*1
45.8%[23.6, 68.0]
67.4%
21.6%
0.0019
欠測例については、多重補完法を用いた。
*1:有意水準両側 5%、McNemar 検定
3.2.
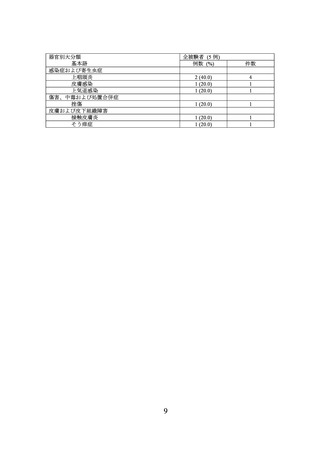
海外第 III 相非盲検継続投与試験(B-VEC-EX-02 試験)
B-VEC-03 試験を終了した DEB 患者(以下、
「継続塗布患者」という)又は本品未治療の
DEB 患者(以下、
「新規患者」という)を対象に、本品の有効性及び安全性を検討する非盲
検非対照海外第 III 相試験(B-VEC-EX-02 試験)が実施された。
主な選択基準は、同意取得の時点で、DEB の症状を示しており、COL7A1 を含む遺伝子検
査で DEB の診断[DDEB 又は RDEB のいずれか]が確認されていることであった。
主な除外基準は、皮膚移植又はメッシュ皮膚移植の実施中の患者、過去 3 カ月以内に本品
以外の臨床試験に参加していることであった。
本品の用量は表 4 のとおりであり、投与ごとに各創傷の創傷面積に応じて投与量を変更
することとされた。本品は、シリンジを用いて創傷全体に 1 cm×1 cm のパターンで等間隔
に小さな液滴を塗布することとされ、本品の塗布後、創傷より 1~2 cm ほど大きめにカット
した疎水性被覆材を貼付することとされた。その後、医療従事者又は介護者が、疎水性被覆
材の上に患者が希望する標準治療用被覆材を用いて創傷を被覆し、約 24 時間留置すること
とされた。また、表 5 のとおり、年齢に基づき 1 週あたりの最大用量が設定され、各創傷に
塗布する本品の用量の合計が 1 週あたりの最大用量を超えないこととされた。
4
B-VEC-03 試験における 1 創傷あたりの本品の用量
患者の創傷面積(cm2)
用量(PFU)
20 未満
4×108
20 以上 40 未満
8×108
40 以上 60 以下
1.2×109
表2
B-VEC-03 試験における 1 週あたりの最大用量
年齢
1 週あたりの最大用量(PFU)
6 カ月以上 3 歳未満
1.6×109
3 歳以上 6 歳未満
2.4×109
6 歳以上
3.2×109
ITT 集団(N=31)において、主要評価項目である初回投与 6 カ月後の創傷の完全治癒(22
及び 24 週目又は 24 及び 26 週目の 2 回の visit で連続しての完全閉鎖注 1))率は、表 3 のと
おりであり、両群間に統計学的な有意差が認められた。
表 3 治験製品の初回投与後 6 カ月における完全治癒した一次創傷の割合(B-VEC-03 試験、ITT 集団)
本品投与創傷
プラセボ投与創傷
群間差[95%CI]
(31 例)
(31 例)
両側 p 値*1
45.8%[23.6, 68.0]
67.4%
21.6%
0.0019
欠測例については、多重補完法を用いた。
*1:有意水準両側 5%、McNemar 検定
3.2.
海外第 III 相非盲検継続投与試験(B-VEC-EX-02 試験)
B-VEC-03 試験を終了した DEB 患者(以下、
「継続塗布患者」という)又は本品未治療の
DEB 患者(以下、
「新規患者」という)を対象に、本品の有効性及び安全性を検討する非盲
検非対照海外第 III 相試験(B-VEC-EX-02 試験)が実施された。
主な選択基準は、同意取得の時点で、DEB の症状を示しており、COL7A1 を含む遺伝子検
査で DEB の診断[DDEB 又は RDEB のいずれか]が確認されていることであった。
主な除外基準は、皮膚移植又はメッシュ皮膚移植の実施中の患者、過去 3 カ月以内に本品
以外の臨床試験に参加していることであった。
本品の用量は表 4 のとおりであり、投与ごとに各創傷の創傷面積に応じて投与量を変更
することとされた。本品は、シリンジを用いて創傷全体に 1 cm×1 cm のパターンで等間隔
に小さな液滴を塗布することとされ、本品の塗布後、創傷より 1~2 cm ほど大きめにカット
した疎水性被覆材を貼付することとされた。その後、医療従事者又は介護者が、疎水性被覆
材の上に患者が希望する標準治療用被覆材を用いて創傷を被覆し、約 24 時間留置すること
とされた。また、表 5 のとおり、年齢に基づき 1 週あたりの最大用量が設定され、各創傷に
塗布する本品の用量の合計が 1 週あたりの最大用量を超えないこととされた。
4