よむ、つかう、まなぶ。
総ー6-1最適使用推進ガイドラインについて[562KB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64494.html |
| 出典情報 | 中央社会保険医療協議会 総会(第620回 10/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
する再生医療等製品である。HSV-1 の KOS 株に由来し、hCMV プロモーター、ヒト COL7A1
遺伝子、及び BGH のポリアデニル化シグナル配列から構成される遺伝子発現カセットが組
み込まれている。患者の創傷部位に塗布された本品が真皮のヒト皮膚線維芽細胞及びヒト
表皮角化細胞に感染することにより、本品のウイルスゲノムは細胞の核内にエピソームと
して留まるとともに、ヒト皮膚線維芽細胞及びヒト表皮角化細胞において機能的なⅦ型コ
ラーゲン(以下、
「COL7 タンパク質」という。
)を発現する。発現した COL7 タンパク質に
より、係留線維が形成され、表皮と真皮が繋ぎ止められることで、DEB 患者の創傷を治癒
する効果が期待される。
3.
臨床成績
DEB の承認時に評価を行った主な臨床試験の成績を示す。
【有効性】
3.1.
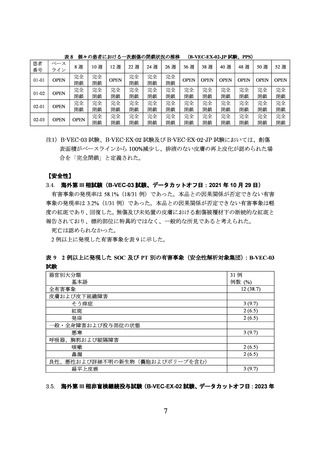
海外第 III 相試験(B-VEC-03 試験)
DEB 患者を対象に、本品の有効性及び安全性を検討する二重盲検被験者内プラセボ対照
海外第 III 相試験(B-VEC-03 試験)が実施された。
主な選択基準は、同意取得の時点で生後 6 カ月以上であり、DEB の臨床診断を受け、
COL7A1 を含む遺伝子検査で DEB の診断[優性栄養障害型表皮水疱症(以下、
「DDEB」と
いう。
)又は劣性栄養障害型表皮水疱症(以下、
「RDEB」という。
)のいずれか]が確認され
ていることであった。被験者には、以下の基準を満たす 2 つの皮膚創傷が必要であった。
•
部位:サイズ、解剖学的部位及び外観が 2 つの創傷間で類似している。
•
外観:肉芽組織が十分にあり、脈管形成が良好で感染していない。
主な除外基準は、治療を受ける部位に扁平上皮癌の現病歴又は既往歴があること、1 週目
の時点で被験者が化学療法又は免疫療法を受けていること、過去 3 カ月以内に本品以外の
臨床試験に参加していること、過去 3 カ月以内に皮膚移植を受けていることであった。
治験責任医師により、各患者において大きさ、解剖学的な部位及び外観が類似している 2
つの創傷(一次創傷)が選択され、それぞれ本品又はプラセボに無作為に割り付けられた。
二重盲検下で、各一次創傷のペアには表 1 の用量の本品又はプラセボを、最大 26 週間又は
創傷が閉鎖するまで週 1 回塗布することとされた。また、一次創傷のペアに加えて、治験責
任医師により最大 4 つの二次創傷が選択され、非盲検下で規定の用量の本品を週 1 回塗布
することとされた。二次創傷への投与は表 2 の 1 週あたりの最大用量から一次創傷のペア
に投与された用量を差し引いた分で賄うこととされ、一次創傷のペア及び二次創傷に投与
される用量の合計が 1 週あたりの最大用量を超えないこととされた。本品又はプラセボ投
与後、被験者は治療した創傷を約 24 時間覆っておくこととされた。
3
遺伝子、及び BGH のポリアデニル化シグナル配列から構成される遺伝子発現カセットが組
み込まれている。患者の創傷部位に塗布された本品が真皮のヒト皮膚線維芽細胞及びヒト
表皮角化細胞に感染することにより、本品のウイルスゲノムは細胞の核内にエピソームと
して留まるとともに、ヒト皮膚線維芽細胞及びヒト表皮角化細胞において機能的なⅦ型コ
ラーゲン(以下、
「COL7 タンパク質」という。
)を発現する。発現した COL7 タンパク質に
より、係留線維が形成され、表皮と真皮が繋ぎ止められることで、DEB 患者の創傷を治癒
する効果が期待される。
3.
臨床成績
DEB の承認時に評価を行った主な臨床試験の成績を示す。
【有効性】
3.1.
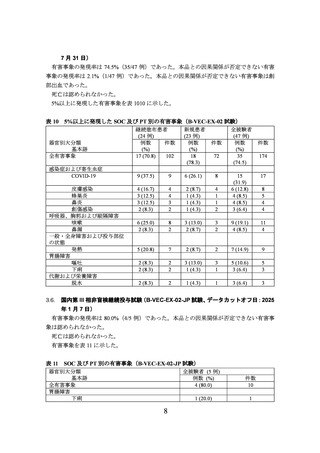
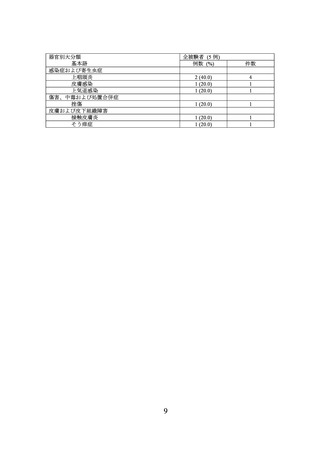
海外第 III 相試験(B-VEC-03 試験)
DEB 患者を対象に、本品の有効性及び安全性を検討する二重盲検被験者内プラセボ対照
海外第 III 相試験(B-VEC-03 試験)が実施された。
主な選択基準は、同意取得の時点で生後 6 カ月以上であり、DEB の臨床診断を受け、
COL7A1 を含む遺伝子検査で DEB の診断[優性栄養障害型表皮水疱症(以下、
「DDEB」と
いう。
)又は劣性栄養障害型表皮水疱症(以下、
「RDEB」という。
)のいずれか]が確認され
ていることであった。被験者には、以下の基準を満たす 2 つの皮膚創傷が必要であった。
•
部位:サイズ、解剖学的部位及び外観が 2 つの創傷間で類似している。
•
外観:肉芽組織が十分にあり、脈管形成が良好で感染していない。
主な除外基準は、治療を受ける部位に扁平上皮癌の現病歴又は既往歴があること、1 週目
の時点で被験者が化学療法又は免疫療法を受けていること、過去 3 カ月以内に本品以外の
臨床試験に参加していること、過去 3 カ月以内に皮膚移植を受けていることであった。
治験責任医師により、各患者において大きさ、解剖学的な部位及び外観が類似している 2
つの創傷(一次創傷)が選択され、それぞれ本品又はプラセボに無作為に割り付けられた。
二重盲検下で、各一次創傷のペアには表 1 の用量の本品又はプラセボを、最大 26 週間又は
創傷が閉鎖するまで週 1 回塗布することとされた。また、一次創傷のペアに加えて、治験責
任医師により最大 4 つの二次創傷が選択され、非盲検下で規定の用量の本品を週 1 回塗布
することとされた。二次創傷への投与は表 2 の 1 週あたりの最大用量から一次創傷のペア
に投与された用量を差し引いた分で賄うこととされ、一次創傷のペア及び二次創傷に投与
される用量の合計が 1 週あたりの最大用量を超えないこととされた。本品又はプラセボ投
与後、被験者は治療した創傷を約 24 時間覆っておくこととされた。
3