よむ、つかう、まなぶ。
参考資料3 がん対策推進基本計画中間評価報告書(平成27年6月) (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25437.html |
| 出典情報 | がん対策推進協議会(第79回 4/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
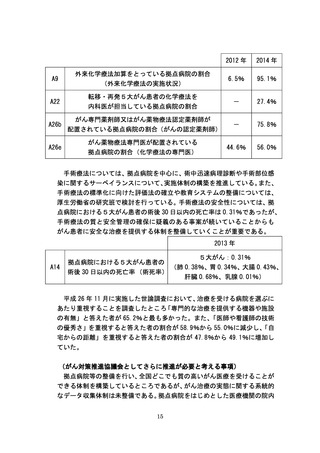
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
新医薬品
B1
ドラッグラグ
(ドラッグラグ・早期承認)
2012 年
2013 年
<申請ラグ>
32.9 ヶ月
<審査ラグ>
1.6 ヶ月
<申請ラグ>
5.7 ヶ月
<審査ラグ>
0ヶ月
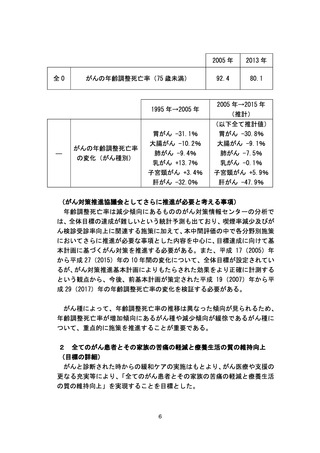
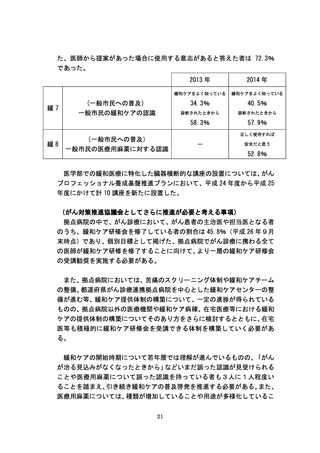
未承認薬・適応外薬の開発促進にあたっては、平成 24 年度から平成 26 年
度までに計 11 回の「医療上の必要性の高い未承認薬・適応外薬検討会議」
を開催し、平成 23 年9月 30 日までにとりまとめた抗悪性腫瘍剤に関する要
望は、医療上の必要性の評価を終えた。このうち、指標研究班の調査では、
医療上の必要性が高いと判断されたがん関連薬剤の中で、薬事承認・適応拡
大されたものは平成 24 年度に 14 種類、平成 25 年度に 14 種類あった。また、
平成 25 年度より抗がん剤の最先端医療迅速評価制度(先進医療ハイウェイ
構想)を創設し、上記検討会議において医療上の必要性が高いとされた抗が
ん剤について、外部機関による専門評価体制を活用することにより、先進医
療の評価の迅速化・効率化を図っている。
B1a
アンメットメディカルニーズ
(新規に製造販売承認もしくは
適応拡大されたがん関連薬剤)
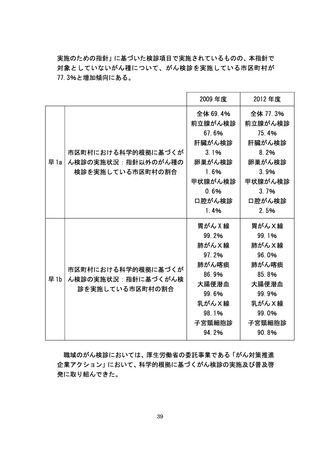
第 I 回要望
第 II 回要望
要望 116
開発要請 45
H23 承認 19
H24 承認 3
H25 承認 3
要望 75
開発要請 32
H23 承認 -H24 承認 11
H25 承認 11
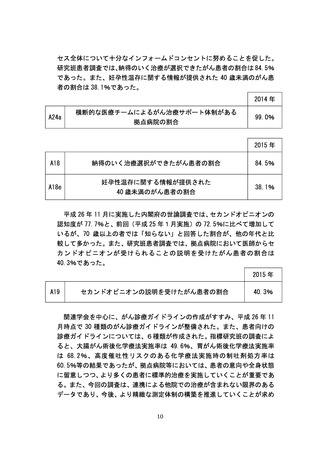
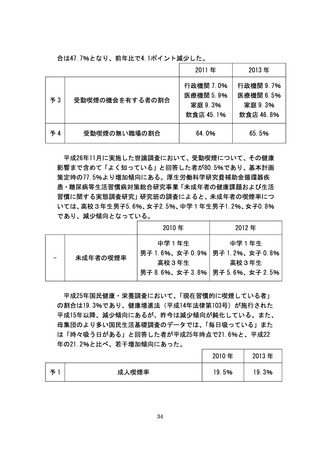
なお、がんを含め、困難な病気と闘う患者からの申出を起点とし、安全性・
有効性を確認しつつ、国内未承認医薬品等の使用や国内承認済みの医薬品等
の適応外使用など、先進的な医療を保険外併用療養として迅速に受けられる
仕組みとして、「患者申出療養」を創設する予定である。
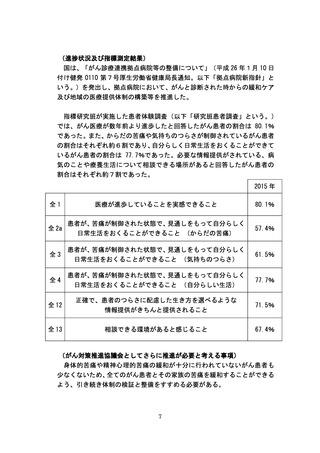
(がん対策推進協議会としてさらに推進が必要と考える事項)
がんに関する医薬品・医療機器の開発については、AMEDと連携しつつ、
「がん研究10か年戦略」に基づいて、アンメットメディカルニーズに応え
る新規薬剤開発に関する研究や患者に優しい新規医療技術開発に関する研
究等を推進していく必要がある。また、PMDAの薬事戦略相談を活用する
よう、研究者に周知することにより早期承認に向けた効率的な研究開発を推
25
B1
ドラッグラグ
(ドラッグラグ・早期承認)
2012 年
2013 年
<申請ラグ>
32.9 ヶ月
<審査ラグ>
1.6 ヶ月
<申請ラグ>
5.7 ヶ月
<審査ラグ>
0ヶ月
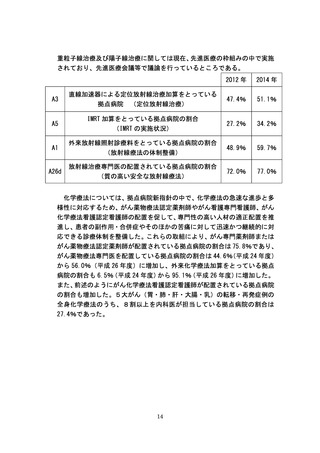
未承認薬・適応外薬の開発促進にあたっては、平成 24 年度から平成 26 年
度までに計 11 回の「医療上の必要性の高い未承認薬・適応外薬検討会議」
を開催し、平成 23 年9月 30 日までにとりまとめた抗悪性腫瘍剤に関する要
望は、医療上の必要性の評価を終えた。このうち、指標研究班の調査では、
医療上の必要性が高いと判断されたがん関連薬剤の中で、薬事承認・適応拡
大されたものは平成 24 年度に 14 種類、平成 25 年度に 14 種類あった。また、
平成 25 年度より抗がん剤の最先端医療迅速評価制度(先進医療ハイウェイ
構想)を創設し、上記検討会議において医療上の必要性が高いとされた抗が
ん剤について、外部機関による専門評価体制を活用することにより、先進医
療の評価の迅速化・効率化を図っている。
B1a
アンメットメディカルニーズ
(新規に製造販売承認もしくは
適応拡大されたがん関連薬剤)
第 I 回要望
第 II 回要望
要望 116
開発要請 45
H23 承認 19
H24 承認 3
H25 承認 3
要望 75
開発要請 32
H23 承認 -H24 承認 11
H25 承認 11
なお、がんを含め、困難な病気と闘う患者からの申出を起点とし、安全性・
有効性を確認しつつ、国内未承認医薬品等の使用や国内承認済みの医薬品等
の適応外使用など、先進的な医療を保険外併用療養として迅速に受けられる
仕組みとして、「患者申出療養」を創設する予定である。
(がん対策推進協議会としてさらに推進が必要と考える事項)
がんに関する医薬品・医療機器の開発については、AMEDと連携しつつ、
「がん研究10か年戦略」に基づいて、アンメットメディカルニーズに応え
る新規薬剤開発に関する研究や患者に優しい新規医療技術開発に関する研
究等を推進していく必要がある。また、PMDAの薬事戦略相談を活用する
よう、研究者に周知することにより早期承認に向けた効率的な研究開発を推
25