よむ、つかう、まなぶ。
参考資料1_治験・臨床試験の推進に関する今後の方向性について 2025年版とりまとめ 参考資料集 (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58747.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第43回 6/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
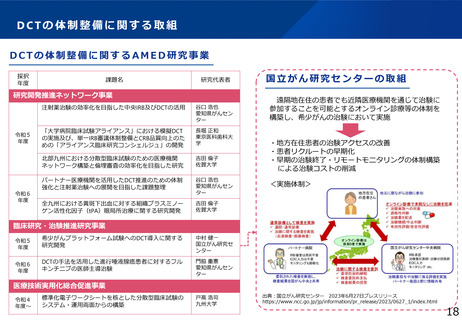
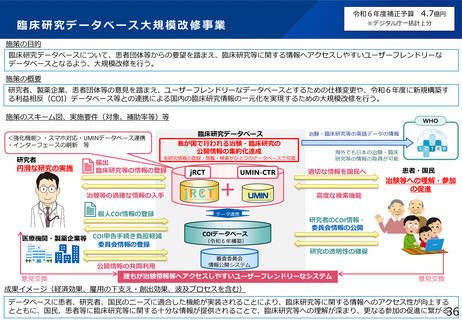
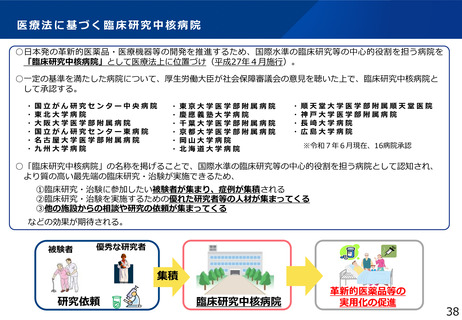
令和6年度厚生労働科学特別研究事業
「日本における臨床試験に係る制度を検討する研究」の概要
研究代表者
楠岡英雄
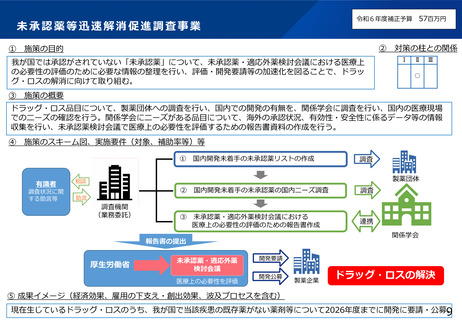
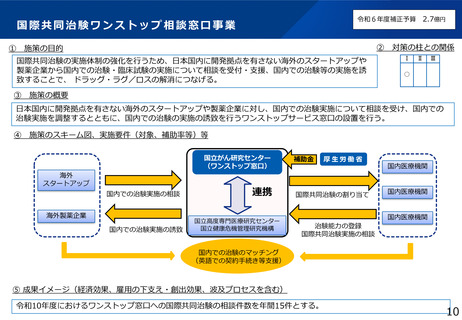
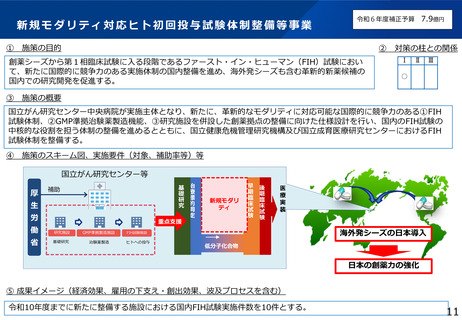
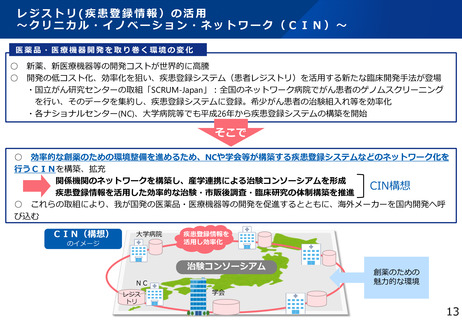
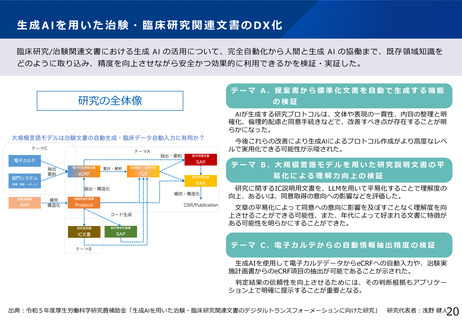
本研究の背景・目的
• 現在の日本においては、煩雑な臨床試験規制及び煩雑な手続のため、臨床試験を実施する場としての魅力が低下し、ドラッグ・ロスの一因となっているとの指摘がある。
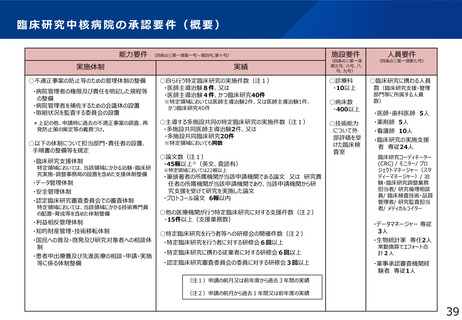
• 他方、臨床研究中核病院の承認要件においては、実施試験数という「入口部分」に重きが置かれており、本来達成すべき「実用化」という「出口」を評価できていない
という問題が発生している。
• 本研究では、①GCP renovationに代表される海外の潮流及び規制調和の観点を踏まえた日本の臨床試験の規制の課題の抽出、②実施体制の面で国際水準の臨床試験の
実施体制を備え、優れた臨床開発力を有する臨床研究中核病院に求められる要件の検討を行い、日本の創薬力の向上に資する提案を行うことを目的とする。本研究の成
果により、我が国が世界トップレベルの創薬の地となることを期待できる。
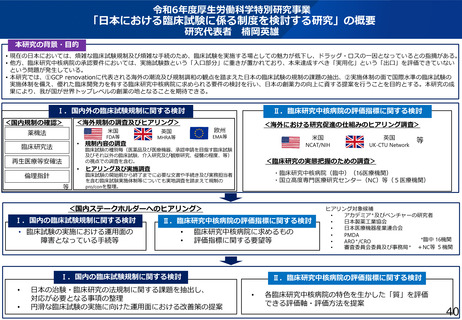
Ⅰ.国内外の臨床試験規制に関する検討
Ⅱ.臨床研究中核病院の評価指標に関する検討
<海外規制の調査及びヒアリング>
<国内規制の確認>
米国
薬機法
FDA等
臨床研究法
•
規制内容の調査
•
ヒアリング及び実施調査
再生医療等安確法
倫理指針
等
<海外における研究促進の仕組みのヒアリング調査>
欧州
英国
EMA等
MHRA等
臨床試験の種別毎(医薬品及び医療機器、承認申請を目指す臨床試験
及びそれ以外の臨床試験、介入研究及び観察研究、侵襲の程度、等)
の視点での調査を含む。
米国
英国
NCAT/NIH
UK-CTU Network
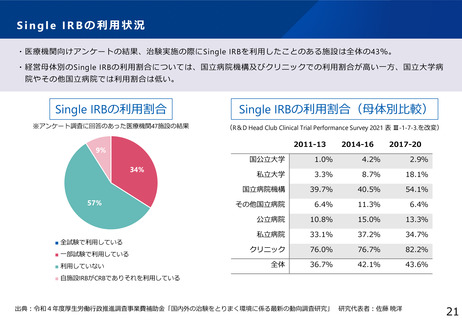
<臨床研究の実態把握のための調査>
・臨床研究中核病院(臨中)(16医療機関)
・国立高度専門医療研究センター(NC)等(5医療機関)
臨床試験の開始前から終了までに必要な文書や手続き及び実務担当者
を含む臨床試験実施体制等についても実地調査を踏まえて規制の
pro/conを整理。
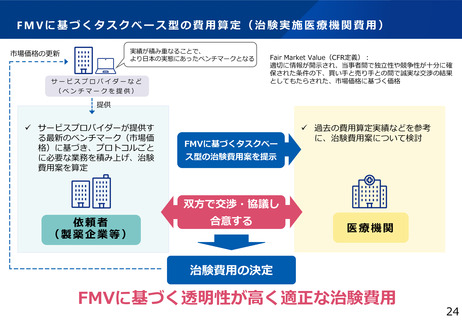
<国内ステークホルダーへのヒアリング>
Ⅰ.国内の臨床試験規制に関する検討
• 臨床試験の実施における運用面の
障害となっている手続等
Ⅱ.臨床研究中核病院の評価指標に関する検討
•
•
臨床研究中核病院に求めるもの
評価指標に関する要望等
Ⅰ.国内の臨床試験規制に関する検討
•
•
日本の治験・臨床研究の法規制に関する課題を抽出し、
対応が必要となる事項の整理
円滑な臨床試験の実施に向けた運用面における改善策の提案
等
ヒアリング対象候補
•
アカデミア*及びベンチャーの研究者
•
日本製薬工業協会
•
日本医療機器産業連合会
•
PMDA
*臨中 16機関
•
ARO*/CRO
*
+NC等 5機関
•
審査委員会委員及び事務局
Ⅱ.臨床研究中核病院の評価指標に関する検討
•
各臨床研究中核病院の特色を生かした「質」を評価
できる評価軸・評価方法を提案
40
「日本における臨床試験に係る制度を検討する研究」の概要
研究代表者
楠岡英雄
本研究の背景・目的
• 現在の日本においては、煩雑な臨床試験規制及び煩雑な手続のため、臨床試験を実施する場としての魅力が低下し、ドラッグ・ロスの一因となっているとの指摘がある。
• 他方、臨床研究中核病院の承認要件においては、実施試験数という「入口部分」に重きが置かれており、本来達成すべき「実用化」という「出口」を評価できていない
という問題が発生している。
• 本研究では、①GCP renovationに代表される海外の潮流及び規制調和の観点を踏まえた日本の臨床試験の規制の課題の抽出、②実施体制の面で国際水準の臨床試験の
実施体制を備え、優れた臨床開発力を有する臨床研究中核病院に求められる要件の検討を行い、日本の創薬力の向上に資する提案を行うことを目的とする。本研究の成
果により、我が国が世界トップレベルの創薬の地となることを期待できる。
Ⅰ.国内外の臨床試験規制に関する検討
Ⅱ.臨床研究中核病院の評価指標に関する検討
<海外規制の調査及びヒアリング>
<国内規制の確認>
米国
薬機法
FDA等
臨床研究法
•
規制内容の調査
•
ヒアリング及び実施調査
再生医療等安確法
倫理指針
等
<海外における研究促進の仕組みのヒアリング調査>
欧州
英国
EMA等
MHRA等
臨床試験の種別毎(医薬品及び医療機器、承認申請を目指す臨床試験
及びそれ以外の臨床試験、介入研究及び観察研究、侵襲の程度、等)
の視点での調査を含む。
米国
英国
NCAT/NIH
UK-CTU Network
<臨床研究の実態把握のための調査>
・臨床研究中核病院(臨中)(16医療機関)
・国立高度専門医療研究センター(NC)等(5医療機関)
臨床試験の開始前から終了までに必要な文書や手続き及び実務担当者
を含む臨床試験実施体制等についても実地調査を踏まえて規制の
pro/conを整理。
<国内ステークホルダーへのヒアリング>
Ⅰ.国内の臨床試験規制に関する検討
• 臨床試験の実施における運用面の
障害となっている手続等
Ⅱ.臨床研究中核病院の評価指標に関する検討
•
•
臨床研究中核病院に求めるもの
評価指標に関する要望等
Ⅰ.国内の臨床試験規制に関する検討
•
•
日本の治験・臨床研究の法規制に関する課題を抽出し、
対応が必要となる事項の整理
円滑な臨床試験の実施に向けた運用面における改善策の提案
等
ヒアリング対象候補
•
アカデミア*及びベンチャーの研究者
•
日本製薬工業協会
•
日本医療機器産業連合会
•
PMDA
*臨中 16機関
•
ARO*/CRO
*
+NC等 5機関
•
審査委員会委員及び事務局
Ⅱ.臨床研究中核病院の評価指標に関する検討
•
各臨床研究中核病院の特色を生かした「質」を評価
できる評価軸・評価方法を提案
40