よむ、つかう、まなぶ。
参考資料1_治験・臨床試験の推進に関する今後の方向性について 2025年版とりまとめ 参考資料集 (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58747.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第43回 6/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
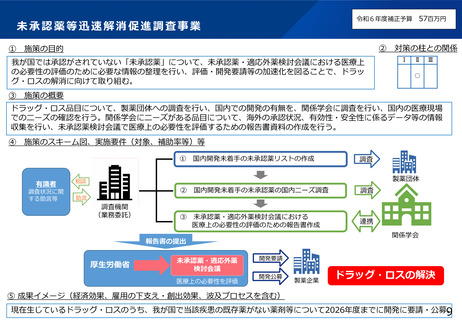
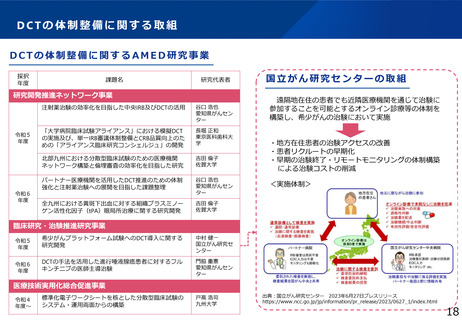
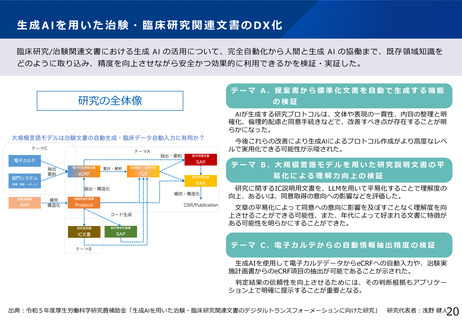
令和6年度補正予算 4.7億円
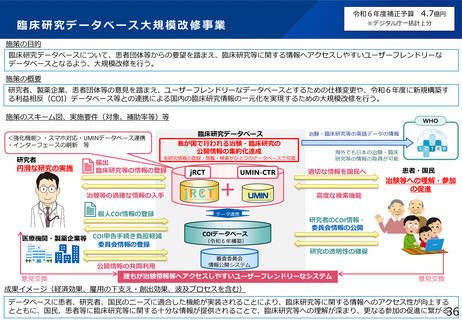
臨床研究データベース大規模改修事業
※デジタル庁一括計上分
施策の目的
臨床研究データベースについて、患者団体等からの要望を踏まえ、臨床研究等に関する情報へアクセスしやすいユーザーフレンドリーな
データベースとなるよう、大規模改修を行う。
施策の概要
研究者、製薬企業、患者団体等の意見を踏まえ、ユーザーフレンドリーなデータベースとするための仕様変更や、令和6年度に新規構築す
る利益相反(COI)データベース等との連携による国内の臨床研究情報の一元化を実現するための大規模改修を行う。
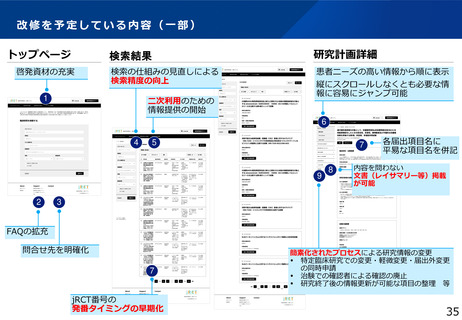
施策のスキーム図、実施要件(対象、補助率等)等
臨床研究データベース
我が国で行われる治験・臨床研究の
公開情報の集約化達成
<強化機能>・スマホ対応・UMINデータベース連携
・インターフェースの刷新 等
研究者
円滑な研究の実施
治験・臨床研究等の英語データの情報
海外でも日本の治験・臨床
研究等の情報の取得が可能
全研究情報の登録・閲覧・検索がひとつのデータベースで可能
届出
臨床研究等の情報の登録
jRCT
UMIN-CTR
治験等の適確な情報の入手
+
個人COI情報の登録
データ連携
医療機関・製薬企業等 COI申告手続き負担軽減
委員会情報の登録
公開情報の共同利用
意見交換
WHO
COIデータベース
適切な情報を国民へ
高度な検索機能
患者・国民
治験等への理解・参加
の促進
研究者のCOI情報・
委員会情報の公開
(令和6年構築)
研究の透明性の確保
審査委員会
情報公開システム
誰もが治験情報等へアクセスしやすいユーザーフレンドリーなシステム
意見交換
成果イメージ(経済効果、雇用の下支え・創出効果、波及プロセスを含む)
データベースに患者、研究者、国民のニーズに適合した機能が実装されることにより、臨床研究等に関する情報へのアクセス性が向上する
とともに、国民、患者等に臨床研究等に関する十分な情報が提供されることで、臨床研究等への理解が深まり、更なる参加の促進に繋がる。
36
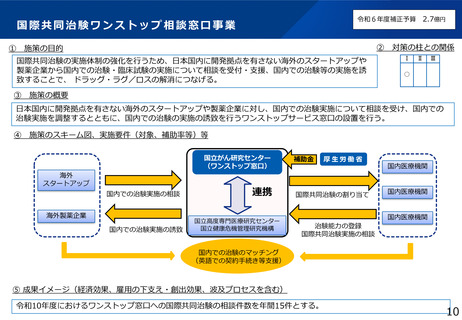
臨床研究データベース大規模改修事業
※デジタル庁一括計上分
施策の目的
臨床研究データベースについて、患者団体等からの要望を踏まえ、臨床研究等に関する情報へアクセスしやすいユーザーフレンドリーな
データベースとなるよう、大規模改修を行う。
施策の概要
研究者、製薬企業、患者団体等の意見を踏まえ、ユーザーフレンドリーなデータベースとするための仕様変更や、令和6年度に新規構築す
る利益相反(COI)データベース等との連携による国内の臨床研究情報の一元化を実現するための大規模改修を行う。
施策のスキーム図、実施要件(対象、補助率等)等
臨床研究データベース
我が国で行われる治験・臨床研究の
公開情報の集約化達成
<強化機能>・スマホ対応・UMINデータベース連携
・インターフェースの刷新 等
研究者
円滑な研究の実施
治験・臨床研究等の英語データの情報
海外でも日本の治験・臨床
研究等の情報の取得が可能
全研究情報の登録・閲覧・検索がひとつのデータベースで可能
届出
臨床研究等の情報の登録
jRCT
UMIN-CTR
治験等の適確な情報の入手
+
個人COI情報の登録
データ連携
医療機関・製薬企業等 COI申告手続き負担軽減
委員会情報の登録
公開情報の共同利用
意見交換
WHO
COIデータベース
適切な情報を国民へ
高度な検索機能
患者・国民
治験等への理解・参加
の促進
研究者のCOI情報・
委員会情報の公開
(令和6年構築)
研究の透明性の確保
審査委員会
情報公開システム
誰もが治験情報等へアクセスしやすいユーザーフレンドリーなシステム
意見交換
成果イメージ(経済効果、雇用の下支え・創出効果、波及プロセスを含む)
データベースに患者、研究者、国民のニーズに適合した機能が実装されることにより、臨床研究等に関する情報へのアクセス性が向上する
とともに、国民、患者等に臨床研究等に関する十分な情報が提供されることで、臨床研究等への理解が深まり、更なる参加の促進に繋がる。
36