よむ、つかう、まなぶ。
参考資料1_治験・臨床試験の推進に関する今後の方向性について 2025年版とりまとめ 参考資料集 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58747.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第43回 6/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
「治験・臨床試験の推進に関する今後の方向性について
2025年版とりまとめ」概要
とりまとめの背景
2019年に行った治験活性化のとりまとめから5年が経過し、臨床研究を取り巻く環境が変化したこと、政府の創薬力向上に関する取
組が掲げられたことを踏まえ、新たな治験活性化策を厚生科学審議会臨床研究部会において策定する。
各項目の対応等
Ⅰ
国際競争力のある治験・臨床試験体制の強化
・国際共同治験・臨床試験を主導できる人材の育成
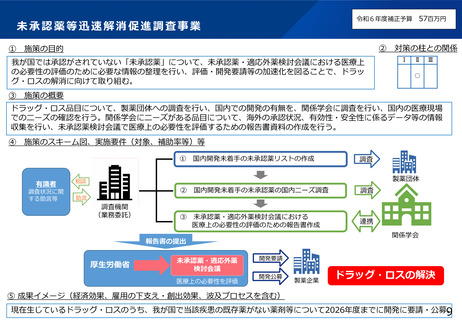
・ドラッグ・ロスへの対応
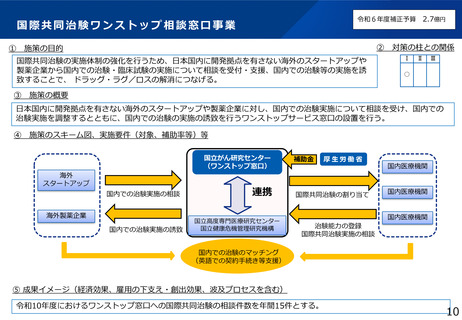
・国際共同治験のためのワンストップ相談窓口の設置
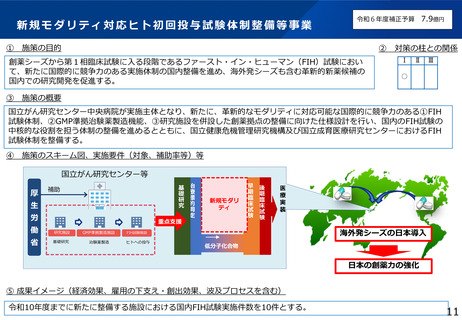
・ヒト初回投与試験の体制整備
・臨床研究中核病院以外の施設の治験・臨床試験レベルの向上
Ⅱ 症例集積力の向上
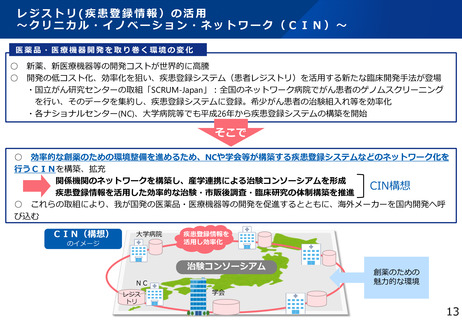
・レジストリ・リアルワールドデータの利活用の促進
・クリニカル・イノベーション・ネットワーク構想の進展
・分散型治験を実施可能な体制の整備と効率の良い適用・運用方法の模索
・臨床研究中核病院・NC・JIHS・NHO等間での連携強化
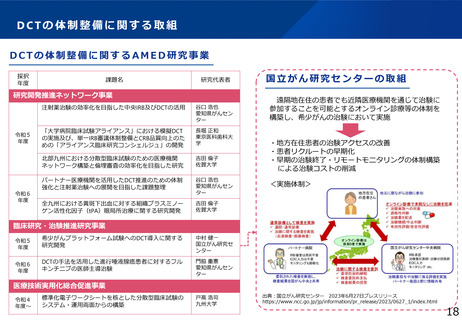
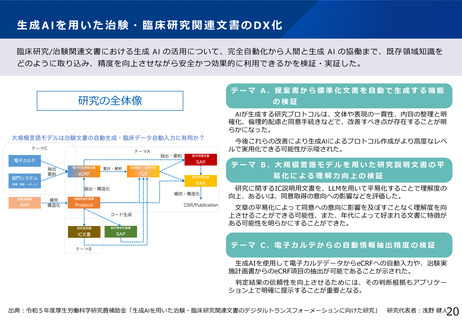
・治験・臨床試験DXの推進
Ⅲ
治験・臨床試験手続きの効率化
・AI関連技術を用いた症例分析など利活用の促進
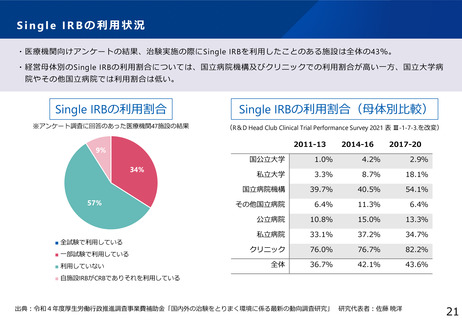
・一括審査を進めるためのSingle IRB化の推進
・ICH-E6 GCPの改定を踏まえた治験手続き等の運用の見直し
・電子カルテ情報を含む治験・臨床試験に必要なデータの標準化
・説明文書・同意文書・契約書等の書類の標準化
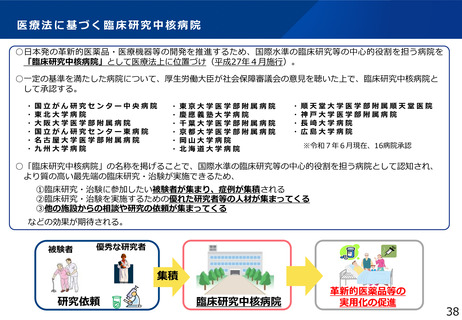
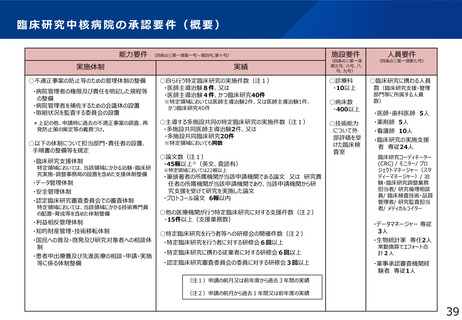
臨床研究中核病院の今後のあり方
Ⅳ
治験コストの透明化の向上
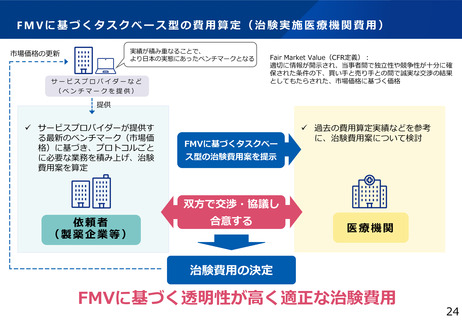
・Fair Market Valueに基づく費用算定の導入推進
・モデル事業等を通じたタスクベース型の費用算定方法の検討
Ⅴ
研究従事者や研究支援人材の育成・インセンティブ
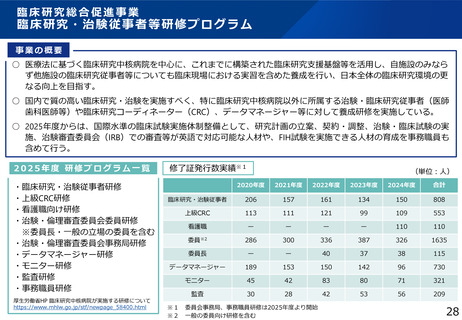
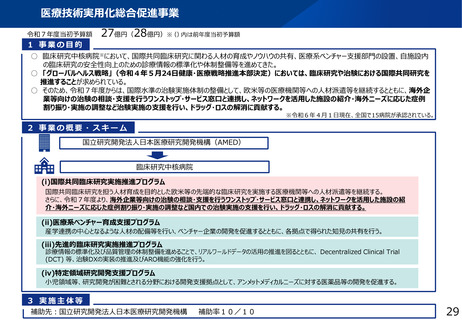
・臨床研究総合促進事業等を通じた人材育成
・研究従事者や研究支援人材のキャリアパス構築、インセンティブ付与に向けた検討
Ⅵ
治験・臨床試験に対する国民・患者の理解・参画促進
・患者・市民参画のガイドラインや広報資料の作成等による啓発・推進
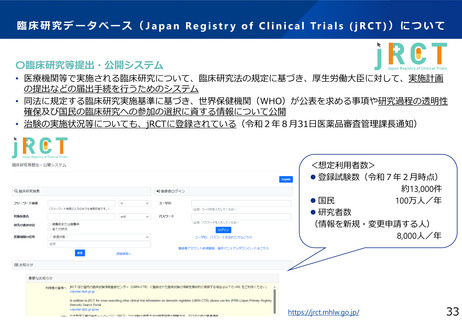
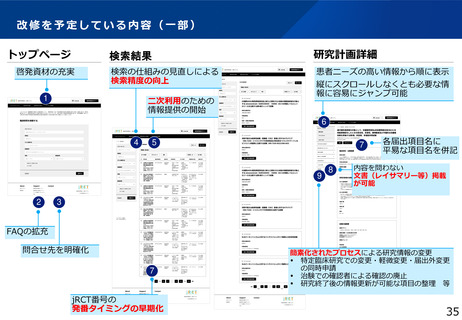
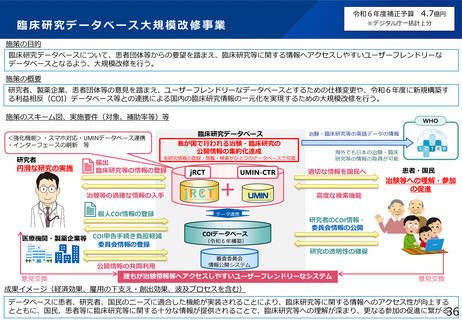
・jRCTをユーザーフレンドリーなデータベースにするための大規模改修
・スマートフォンでアクセスしやすくする等、患者が扱いやすい情報提供の普及
・治験・臨床試験の実施に関する情報公開
Ⅶ
その他
・2019年のとりまとめ後の社会情勢を踏まえた方策
・生成AI等の新たな技術や手法による、医療環境や海外での治験・臨床試験の変化への
備え
・認定臨床研究審査委員会及び治験審査委員会の質の確保
・特定臨床研究における保険外併用療養費制度の周知
・治験・臨床試験以外の臨床研究等について本取りまとめを踏まえた種々の取組
●臨床研究中核病院の役割・機能を踏まえた承認要件の見直し
各拠点の特徴をより評価できるようなポイント制の導入、評価期間の延長、承認の取消基準等の明確化等による承認要件の見直しを検討する。
●国際拠点型臨床研究中核病院(仮称)の新設
国際共同治験・臨床試験実施の主導及び海外からの依頼に対応できる優れた拠点として「国際拠点型臨床研究中核病院」(仮称)の新設を検討する。
●特定領域に係る臨床研究中核病院の見直し
これまでの承認実績がないことやNC等の役割を踏まえ、政策医療領域のネットワークの強化とあわせて、廃止を含めた制度の見直しを検討する。
2
2025年版とりまとめ」概要
とりまとめの背景
2019年に行った治験活性化のとりまとめから5年が経過し、臨床研究を取り巻く環境が変化したこと、政府の創薬力向上に関する取
組が掲げられたことを踏まえ、新たな治験活性化策を厚生科学審議会臨床研究部会において策定する。
各項目の対応等
Ⅰ
国際競争力のある治験・臨床試験体制の強化
・国際共同治験・臨床試験を主導できる人材の育成
・ドラッグ・ロスへの対応
・国際共同治験のためのワンストップ相談窓口の設置
・ヒト初回投与試験の体制整備
・臨床研究中核病院以外の施設の治験・臨床試験レベルの向上
Ⅱ 症例集積力の向上
・レジストリ・リアルワールドデータの利活用の促進
・クリニカル・イノベーション・ネットワーク構想の進展
・分散型治験を実施可能な体制の整備と効率の良い適用・運用方法の模索
・臨床研究中核病院・NC・JIHS・NHO等間での連携強化
・治験・臨床試験DXの推進
Ⅲ
治験・臨床試験手続きの効率化
・AI関連技術を用いた症例分析など利活用の促進
・一括審査を進めるためのSingle IRB化の推進
・ICH-E6 GCPの改定を踏まえた治験手続き等の運用の見直し
・電子カルテ情報を含む治験・臨床試験に必要なデータの標準化
・説明文書・同意文書・契約書等の書類の標準化
臨床研究中核病院の今後のあり方
Ⅳ
治験コストの透明化の向上
・Fair Market Valueに基づく費用算定の導入推進
・モデル事業等を通じたタスクベース型の費用算定方法の検討
Ⅴ
研究従事者や研究支援人材の育成・インセンティブ
・臨床研究総合促進事業等を通じた人材育成
・研究従事者や研究支援人材のキャリアパス構築、インセンティブ付与に向けた検討
Ⅵ
治験・臨床試験に対する国民・患者の理解・参画促進
・患者・市民参画のガイドラインや広報資料の作成等による啓発・推進
・jRCTをユーザーフレンドリーなデータベースにするための大規模改修
・スマートフォンでアクセスしやすくする等、患者が扱いやすい情報提供の普及
・治験・臨床試験の実施に関する情報公開
Ⅶ
その他
・2019年のとりまとめ後の社会情勢を踏まえた方策
・生成AI等の新たな技術や手法による、医療環境や海外での治験・臨床試験の変化への
備え
・認定臨床研究審査委員会及び治験審査委員会の質の確保
・特定臨床研究における保険外併用療養費制度の周知
・治験・臨床試験以外の臨床研究等について本取りまとめを踏まえた種々の取組
●臨床研究中核病院の役割・機能を踏まえた承認要件の見直し
各拠点の特徴をより評価できるようなポイント制の導入、評価期間の延長、承認の取消基準等の明確化等による承認要件の見直しを検討する。
●国際拠点型臨床研究中核病院(仮称)の新設
国際共同治験・臨床試験実施の主導及び海外からの依頼に対応できる優れた拠点として「国際拠点型臨床研究中核病院」(仮称)の新設を検討する。
●特定領域に係る臨床研究中核病院の見直し
これまでの承認実績がないことやNC等の役割を踏まえ、政策医療領域のネットワークの強化とあわせて、廃止を含めた制度の見直しを検討する。
2