よむ、つかう、まなぶ。
使用薬剤の薬価(薬価基準)の一部改正等について 保医発0520第1号令和7年5月20日 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/content/12404000/001490789.pdf |
| 出典情報 | 使用薬剤の薬価(薬価基準)の一部改正等について(5/20付 通知)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
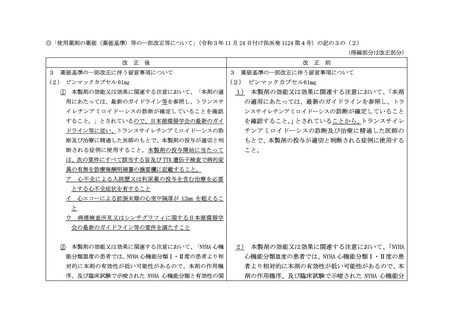
本製剤の投与開始に当たっては、次の要件にすべて該当する旨及び TTR 遺伝子検
査で病的変異の有無を診療報酬明細書の摘要欄に記載すること。
ア 心不全による入院歴又は利尿薬の投与を含む治療を必要とする心不全症状を
有すること
イ 心エコーによる拡張末期の心室中隔厚が 12mm を超えること
ウ 病理検査所見又はシンチグラフィに関する日本循環器学会の最新のガイドラ
イン等の要件を満たすこと
② 本製剤の効能又は効果に関連する注意において、「NYHA 心機能分類Ⅲ度の患者
では、NYHA 心機能分類Ⅰ・Ⅱ度の患者より相対的に本剤の有効性が低い可能性が
あるので、本剤の作用機序、及び臨床試験で示唆された NYHA 心機能分類と有効性
の関係を十分に理解し、患者の状態を考慮した上で、本剤投与の要否を判断する
こと。」及び「NYHA 心機能分類Ⅳ度の患者における有効性及び安全性は確立して
いない。」とされているので、使用に当たっては十分留意し、本製剤の初回投与
に当たっては、NYHA 心機能分類Ⅰ~Ⅲ度の患者を対象とすること。
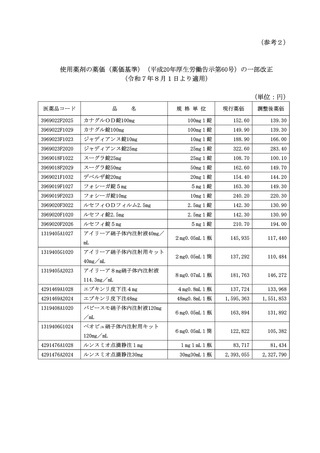
(3) リブマーリ内用液 10mg/mL
① 本製剤は、記2のとおり、新医薬品に係る投与期間制限の例外とされたことを
踏まえ、令和7年6月1日から起算して1年を経過していない間は、概ね1か月
に1回の頻度で診察を行うとともに、概ね2週間に1回の頻度で電話等を用いて、
患者の状態や服薬の状況等を確認すること。また、その間、当該診察時には前回
処方時以降の当該診察及び確認の実施年月日を、本製剤の処方時には体重をそれ
ぞれ診療報酬明細書の摘要欄に記載すること。
② 本製剤は、製剤の特性上、遮光保存であり、原則患者には小分けせずに瓶のま
ま渡すものであることから、不要な残液が生じないよう留意し、以下に示す例を
参考に、薬剤料は瓶単位で算定すること。
例) リブマーリ内用液 10mg/mL 1%30mL1瓶
1日1回 0.15mL 7日分
1日1回 0.30mL 96日分
(4) ティブソボ錠 250 ㎎
本製剤の効能又は効果に関連する注意において、
「十分な経験を有する病理医又は
検査施設における検査により、IDH1 遺伝子変異陽性が確認された患者に投与するこ
と。」とされているので、IDH1 遺伝子変異陽性を確認した検査の実施年月日を診療
報酬明細書に記載すること。
なお、当該検査を実施した月のみ実施年月日を記載すること。ただし、本剤の初
回投与に当たっては、必ず当該検査の実施年月日を記載すること。
(5) ラズクルーズ錠 80mg、同錠 240mg
本製剤の効能又は効果に関連する注意において、
「十分な経験を有する病理医又は
査で病的変異の有無を診療報酬明細書の摘要欄に記載すること。
ア 心不全による入院歴又は利尿薬の投与を含む治療を必要とする心不全症状を
有すること
イ 心エコーによる拡張末期の心室中隔厚が 12mm を超えること
ウ 病理検査所見又はシンチグラフィに関する日本循環器学会の最新のガイドラ
イン等の要件を満たすこと
② 本製剤の効能又は効果に関連する注意において、「NYHA 心機能分類Ⅲ度の患者
では、NYHA 心機能分類Ⅰ・Ⅱ度の患者より相対的に本剤の有効性が低い可能性が
あるので、本剤の作用機序、及び臨床試験で示唆された NYHA 心機能分類と有効性
の関係を十分に理解し、患者の状態を考慮した上で、本剤投与の要否を判断する
こと。」及び「NYHA 心機能分類Ⅳ度の患者における有効性及び安全性は確立して
いない。」とされているので、使用に当たっては十分留意し、本製剤の初回投与
に当たっては、NYHA 心機能分類Ⅰ~Ⅲ度の患者を対象とすること。
(3) リブマーリ内用液 10mg/mL
① 本製剤は、記2のとおり、新医薬品に係る投与期間制限の例外とされたことを
踏まえ、令和7年6月1日から起算して1年を経過していない間は、概ね1か月
に1回の頻度で診察を行うとともに、概ね2週間に1回の頻度で電話等を用いて、
患者の状態や服薬の状況等を確認すること。また、その間、当該診察時には前回
処方時以降の当該診察及び確認の実施年月日を、本製剤の処方時には体重をそれ
ぞれ診療報酬明細書の摘要欄に記載すること。
② 本製剤は、製剤の特性上、遮光保存であり、原則患者には小分けせずに瓶のま
ま渡すものであることから、不要な残液が生じないよう留意し、以下に示す例を
参考に、薬剤料は瓶単位で算定すること。
例) リブマーリ内用液 10mg/mL 1%30mL1瓶
1日1回 0.15mL 7日分
1日1回 0.30mL 96日分
(4) ティブソボ錠 250 ㎎
本製剤の効能又は効果に関連する注意において、
「十分な経験を有する病理医又は
検査施設における検査により、IDH1 遺伝子変異陽性が確認された患者に投与するこ
と。」とされているので、IDH1 遺伝子変異陽性を確認した検査の実施年月日を診療
報酬明細書に記載すること。
なお、当該検査を実施した月のみ実施年月日を記載すること。ただし、本剤の初
回投与に当たっては、必ず当該検査の実施年月日を記載すること。
(5) ラズクルーズ錠 80mg、同錠 240mg
本製剤の効能又は効果に関連する注意において、
「十分な経験を有する病理医又は