よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況[1.1MB] (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第3回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
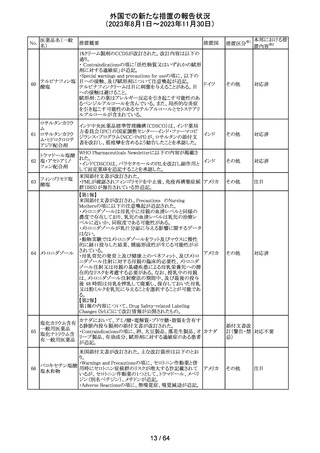
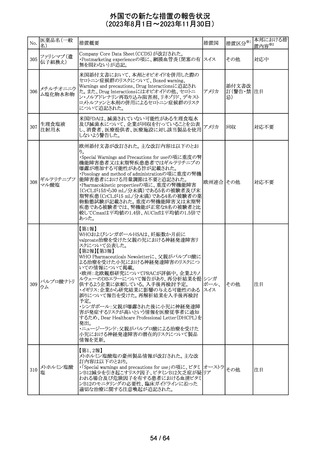
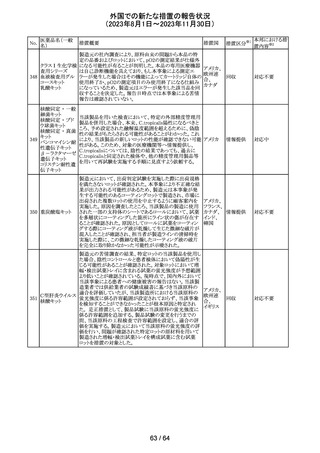
外国での新たな措置の報告状況
(2023年8月1日~2023年11月30日)
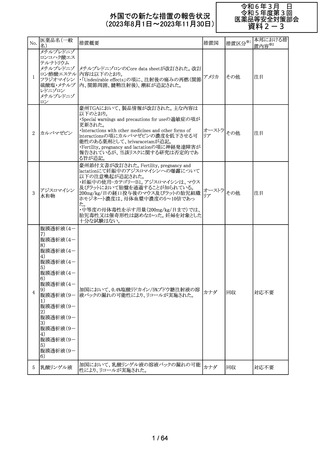
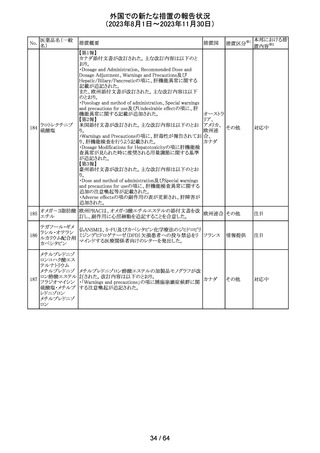
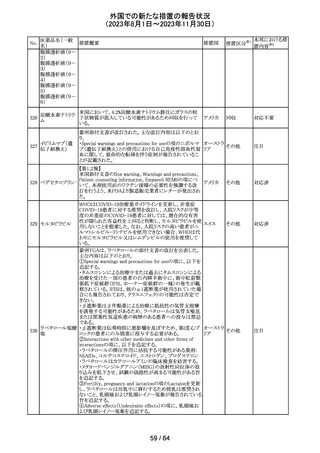
No.
医薬品名(一般
名)
措置概要
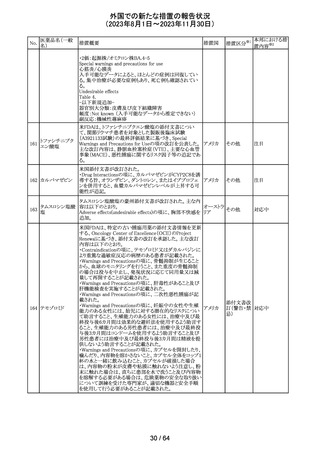
措置国
措置区分※1
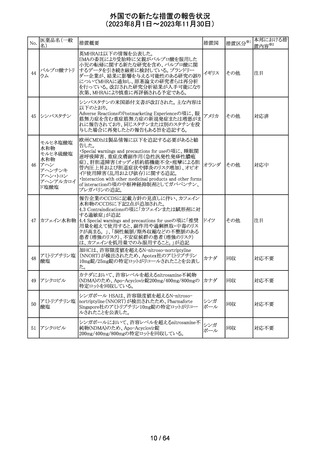
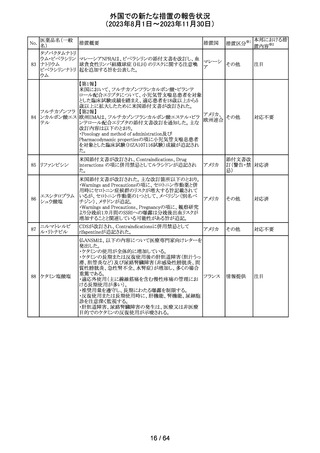
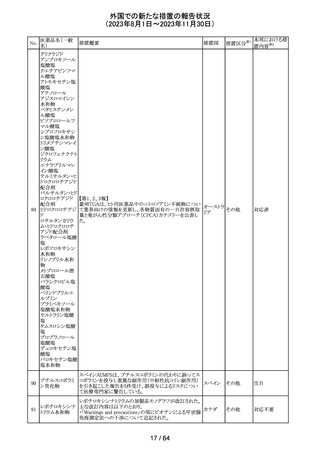
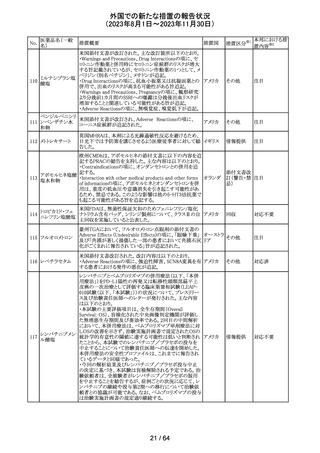
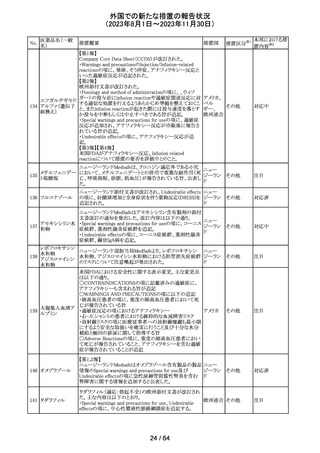
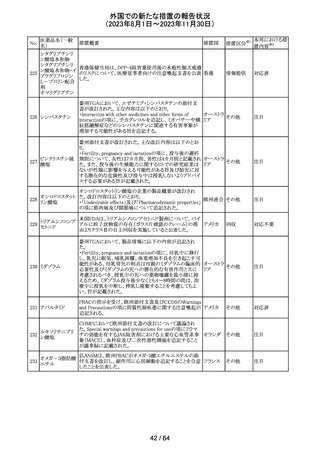
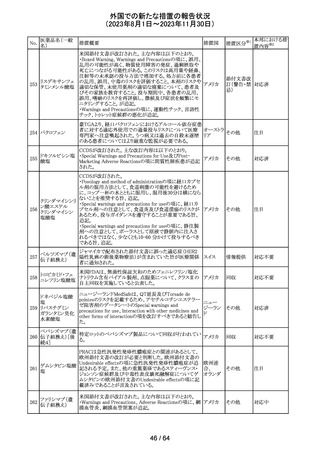
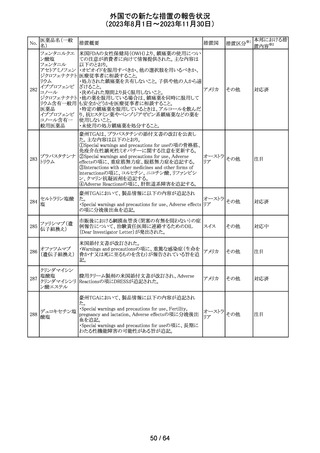
エソメプラゾール、アモキシシリン、クラリスロマイシン含有
製剤の豪州添付文書が改訂された。改訂内容は以下の通
り。
・Special warnings and precautions for useの項に、β-ラク
タム系抗生物質とマクロライド療法を使用している患者で重
篤な、時には致死的な過敏症(アナフィラキシー、アナフィ
ラキシー様反応、重篤な皮膚反応を含む)を起こすことがあ
り、時にコーニス症候群に進行することがある旨、アモキシ
クラリスロマイシン リンについて薬剤性腸炎症候群に関する注意喚起を追
オーストラ
317
その他
クラリスロマイシン 記。また、腎機能障害時の注意として、アモキシシリンの結 リア
晶尿(急性腎障害を含む)の注意を追記。
・Interactions with other medicines and other forms of
interactions?の項に、アモキシシリンの併用注意薬としてプ
ロベネシド、メトトレキセートを追記。
・Adverse effects (undesirable effects)?の項に、アモキシシ
リンの有害事象として、コーニス症候群、薬剤性腸炎症候
群、線状IgA病、間質性腎炎、結晶尿(急性腎障害を含む)
を追記。
本邦における措
置内容※2
対応済
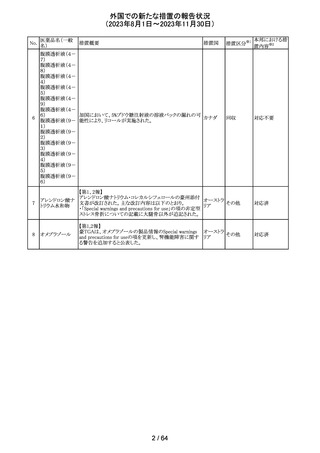
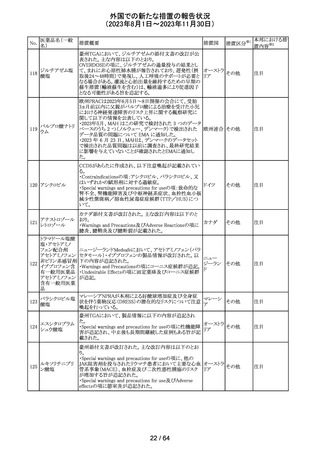
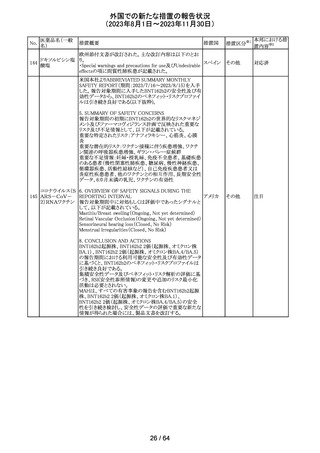
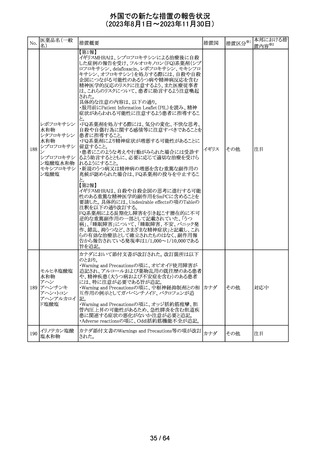
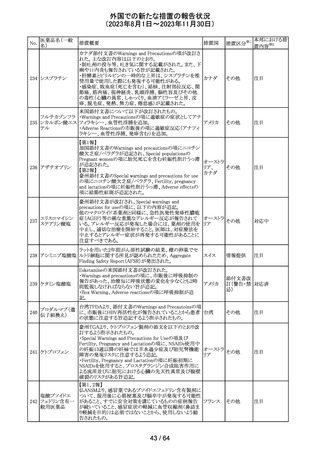
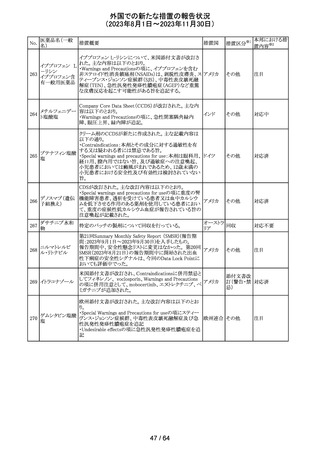
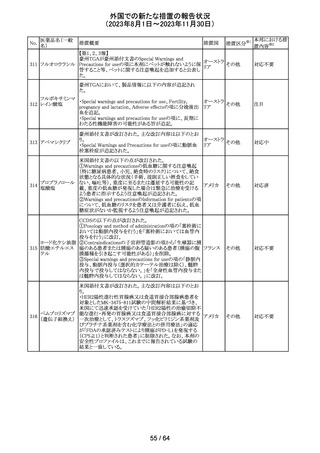
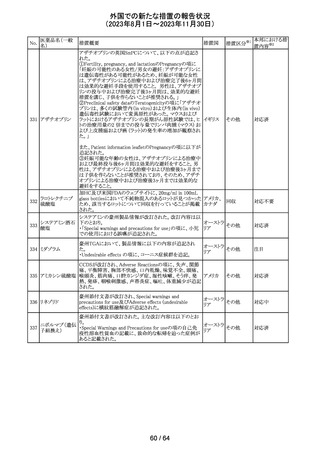
トリメトプリム単独製剤の豪州添付文書が改訂された。改訂
内容は以下の通り。
・Contraindicationsの項に重度の肝機能不全患者を追記。
・Special warnings and precautions for useの項で電解質
異常の記載を更新。
スルファメトキサ ・Interactions with other medicines and other forms of
添付文書改
オーストラ
318 ゾール・トリメトプリ interactions の項で、ワーファリンと他のクマリン、フェニトイ
訂(警告・禁 注目
リア
ム
ン、ジゴキシン、プロカインアミド、抗菌薬(Dapsone:ジア
忌)
フェニルスルホン)、ACE阻害剤の記載を更新。
・Adverse effects (undesirable effects)?? の項に、皮疹、剥
脱性皮膚炎、多形紅斑、Stevens-Johnson syndrome
(SJS)、中毒性表皮壊死融解症(TEN)、そう痒症、血清クレ
アチニンと血中尿窒素レベルの上昇、肝壊死を追記。
319 ミドドリン塩酸塩
豪州TGAは、ミドドリンの添付文書の改訂を公表した。主な
内容は以下のとおり。
①Contraindicationsの項に、急性腎炎、残尿量増加を伴う
前立腺肥大、血管迷走神経性低血圧を追記する。
②Special warnings and precautions for useの項に、仰臥位
高血圧のリスクのため、脳血管発作の既往歴のある患者の
モニタリング、高血圧を伴う糖尿病患者における注意を追
添付文書改
オーストラ
記する。長期投与患者における腎機能及び血圧のモニタリ
訂(警告・禁 注目
リア
ングを追記する。
忌)
③Interactions with other medicines and other forms of
interactionsの項の血管収縮物質のリスト更新、配糖体また
は向精神薬を更新する。
④Adverse effects(undesirable effects)の項に頭部ふらふ
ら感、涙液産生の増加、不整脈、胸痛、脳卒中を追記す
る。
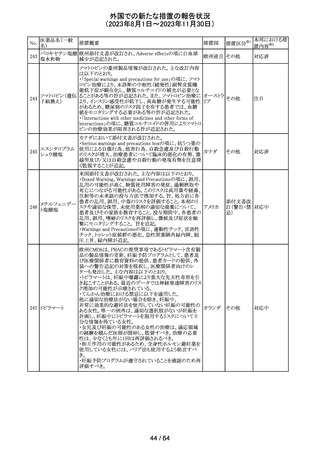
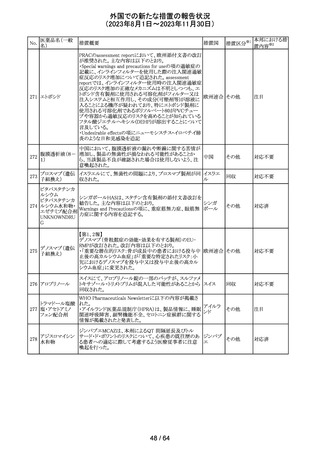
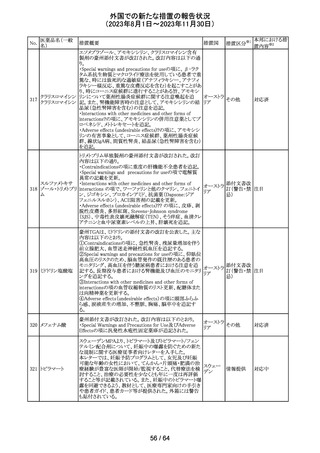
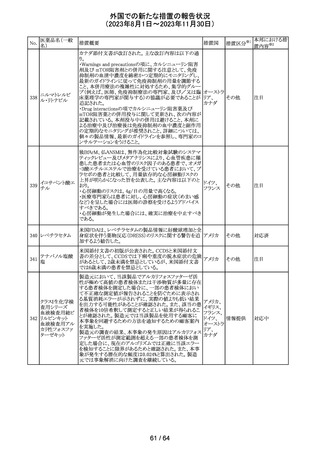
320 メフェナム酸
豪州添付文書が改訂された。改訂内容は以下のとおり。
・Special Warnings and Precautions for Use及びAdverse
Effectsの項に汎発性水疱性固定薬疹が追記された。
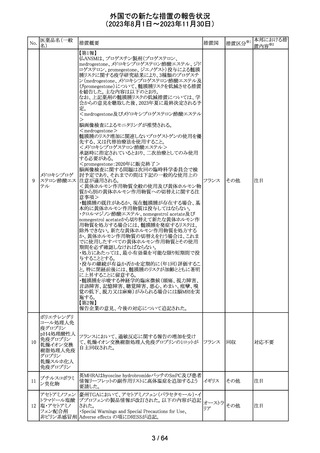
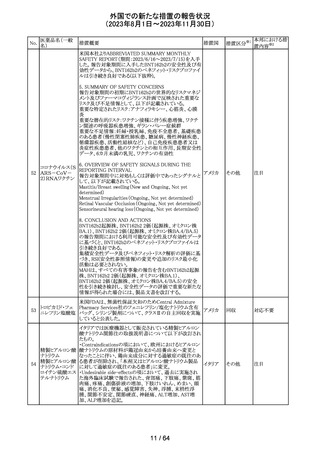
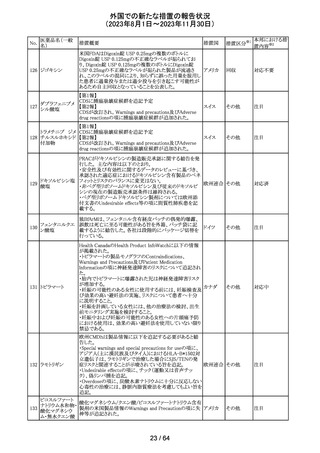
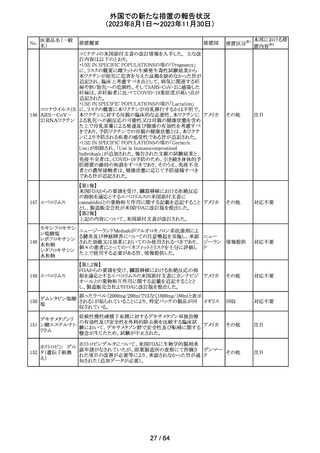
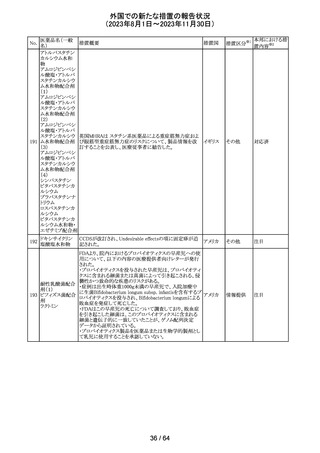
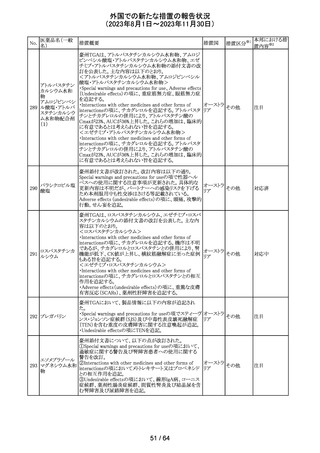
321 トピラマート
スウェーデンMPAより、トピラマート及びトピラマート/フェン
テルミン配合剤について、妊娠中の曝露を防ぐための新た
な規制に関する医療従事者向けレターを入手した。
本レターでは、妊娠予防プログラムとして、女児及び妊娠
可能な年齢の女性において、てんかん・片頭痛・肥満の治
スウェー
療経験が豊富な医師が開始/監視すること、代替療法を検
デン
討すること、治療の必要性を少なくとも年に一度は再評価
すること等が記載されている。また、妊娠中のトピラマート曝
露を回避できるよう、教材として、医療専門家向けの手引き
や患者ガイド、患者カード等が提供された。外箱には警告
も貼付されている。
56 / 64
オーストラ
その他
リア
情報提供
対応済
対応中
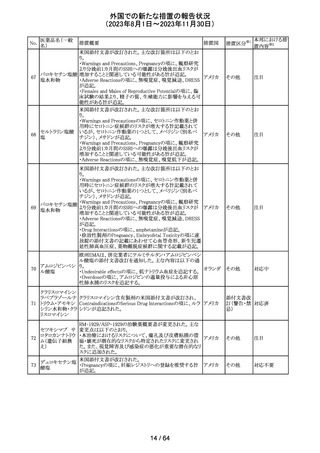
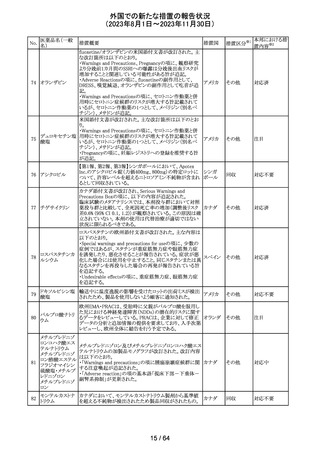
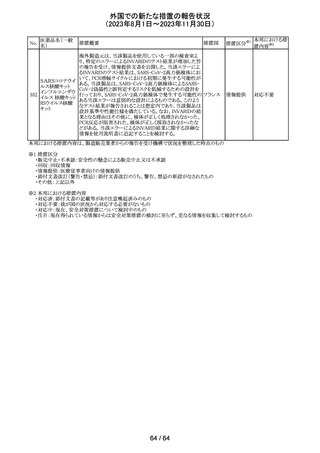
(2023年8月1日~2023年11月30日)
No.
医薬品名(一般
名)
措置概要
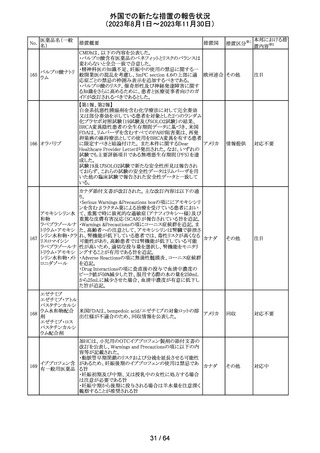
措置国
措置区分※1
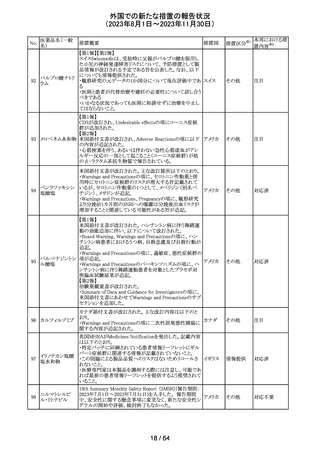
エソメプラゾール、アモキシシリン、クラリスロマイシン含有
製剤の豪州添付文書が改訂された。改訂内容は以下の通
り。
・Special warnings and precautions for useの項に、β-ラク
タム系抗生物質とマクロライド療法を使用している患者で重
篤な、時には致死的な過敏症(アナフィラキシー、アナフィ
ラキシー様反応、重篤な皮膚反応を含む)を起こすことがあ
り、時にコーニス症候群に進行することがある旨、アモキシ
クラリスロマイシン リンについて薬剤性腸炎症候群に関する注意喚起を追
オーストラ
317
その他
クラリスロマイシン 記。また、腎機能障害時の注意として、アモキシシリンの結 リア
晶尿(急性腎障害を含む)の注意を追記。
・Interactions with other medicines and other forms of
interactions?の項に、アモキシシリンの併用注意薬としてプ
ロベネシド、メトトレキセートを追記。
・Adverse effects (undesirable effects)?の項に、アモキシシ
リンの有害事象として、コーニス症候群、薬剤性腸炎症候
群、線状IgA病、間質性腎炎、結晶尿(急性腎障害を含む)
を追記。
本邦における措
置内容※2
対応済
トリメトプリム単独製剤の豪州添付文書が改訂された。改訂
内容は以下の通り。
・Contraindicationsの項に重度の肝機能不全患者を追記。
・Special warnings and precautions for useの項で電解質
異常の記載を更新。
スルファメトキサ ・Interactions with other medicines and other forms of
添付文書改
オーストラ
318 ゾール・トリメトプリ interactions の項で、ワーファリンと他のクマリン、フェニトイ
訂(警告・禁 注目
リア
ム
ン、ジゴキシン、プロカインアミド、抗菌薬(Dapsone:ジア
忌)
フェニルスルホン)、ACE阻害剤の記載を更新。
・Adverse effects (undesirable effects)?? の項に、皮疹、剥
脱性皮膚炎、多形紅斑、Stevens-Johnson syndrome
(SJS)、中毒性表皮壊死融解症(TEN)、そう痒症、血清クレ
アチニンと血中尿窒素レベルの上昇、肝壊死を追記。
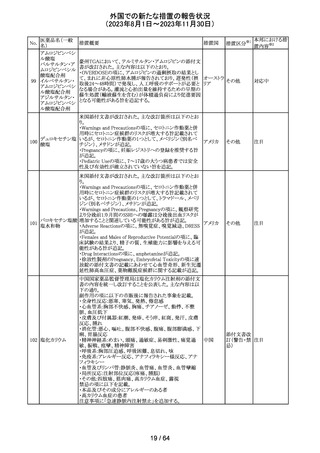
319 ミドドリン塩酸塩
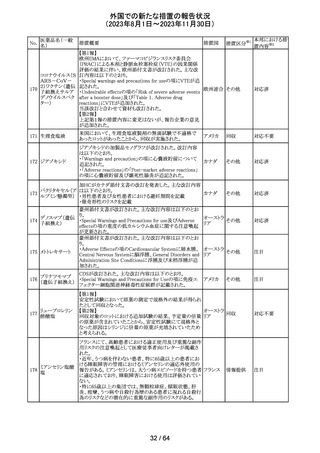
豪州TGAは、ミドドリンの添付文書の改訂を公表した。主な
内容は以下のとおり。
①Contraindicationsの項に、急性腎炎、残尿量増加を伴う
前立腺肥大、血管迷走神経性低血圧を追記する。
②Special warnings and precautions for useの項に、仰臥位
高血圧のリスクのため、脳血管発作の既往歴のある患者の
モニタリング、高血圧を伴う糖尿病患者における注意を追
添付文書改
オーストラ
記する。長期投与患者における腎機能及び血圧のモニタリ
訂(警告・禁 注目
リア
ングを追記する。
忌)
③Interactions with other medicines and other forms of
interactionsの項の血管収縮物質のリスト更新、配糖体また
は向精神薬を更新する。
④Adverse effects(undesirable effects)の項に頭部ふらふ
ら感、涙液産生の増加、不整脈、胸痛、脳卒中を追記す
る。
320 メフェナム酸
豪州添付文書が改訂された。改訂内容は以下のとおり。
・Special Warnings and Precautions for Use及びAdverse
Effectsの項に汎発性水疱性固定薬疹が追記された。
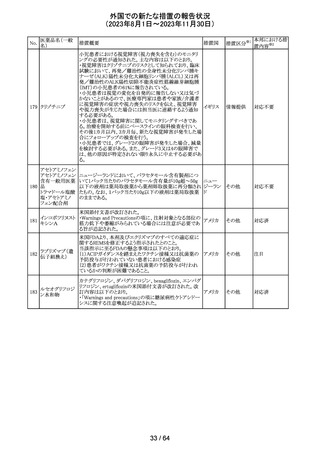
321 トピラマート
スウェーデンMPAより、トピラマート及びトピラマート/フェン
テルミン配合剤について、妊娠中の曝露を防ぐための新た
な規制に関する医療従事者向けレターを入手した。
本レターでは、妊娠予防プログラムとして、女児及び妊娠
可能な年齢の女性において、てんかん・片頭痛・肥満の治
スウェー
療経験が豊富な医師が開始/監視すること、代替療法を検
デン
討すること、治療の必要性を少なくとも年に一度は再評価
すること等が記載されている。また、妊娠中のトピラマート曝
露を回避できるよう、教材として、医療専門家向けの手引き
や患者ガイド、患者カード等が提供された。外箱には警告
も貼付されている。
56 / 64
オーストラ
その他
リア
情報提供
対応済
対応中