よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況[1.1MB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第3回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
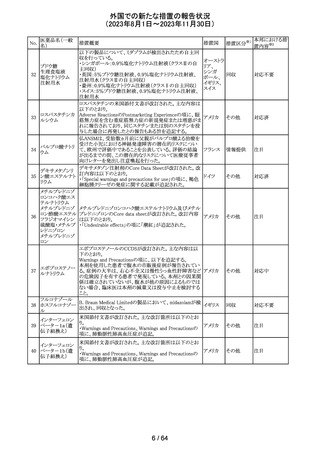
外国での新たな措置の報告状況
(2023年8月1日~2023年11月30日)
No.
医薬品名(一般
名)
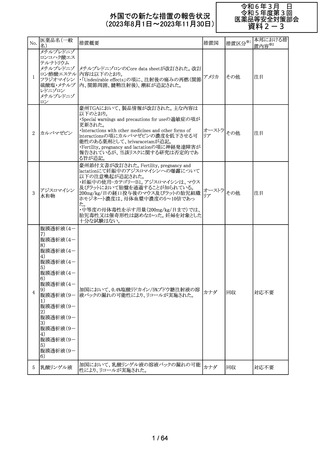
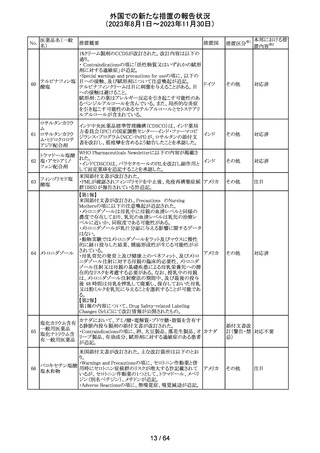
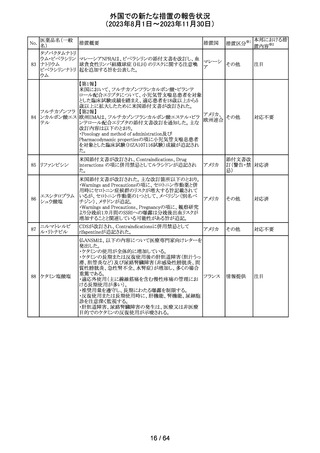
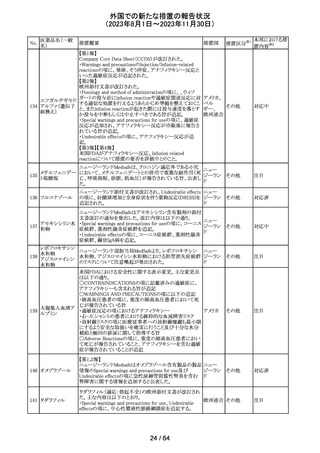
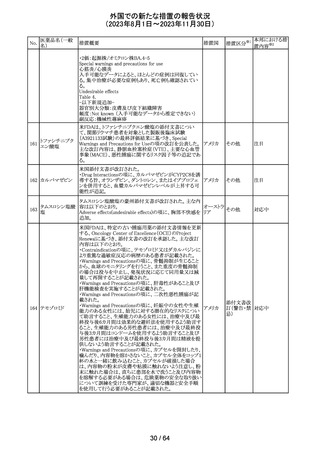
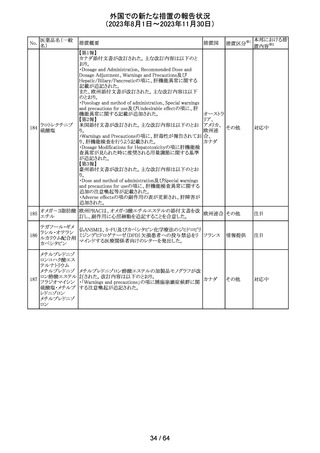
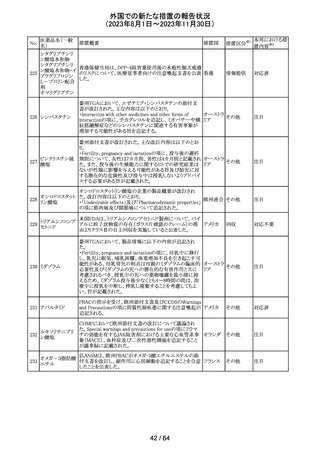
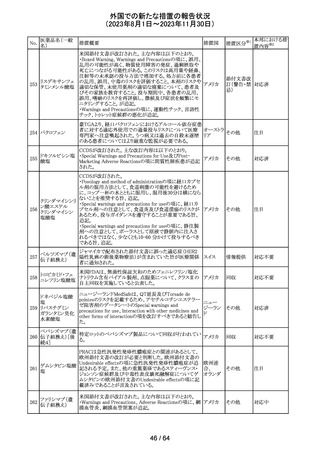
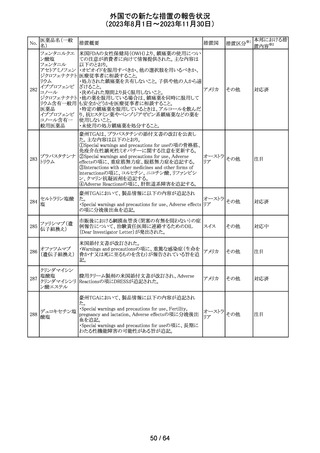
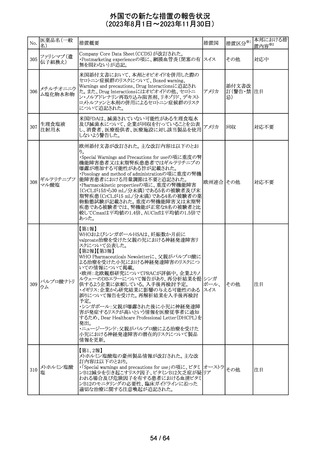
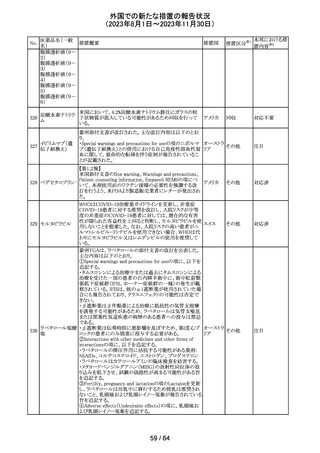
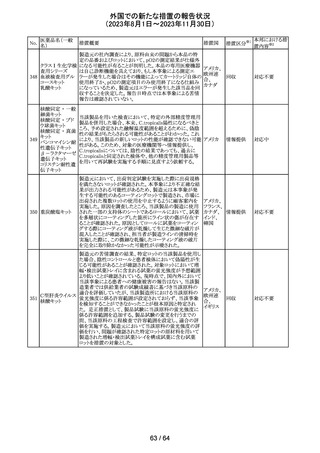
179 クリゾチニブ
措置概要
措置国
小児患者における視覚障害(視力喪失を含む)のモニタリ
ングの必要性が通知された。主な内容は以下のとおり。
・視覚障害はクリゾチニブのリスクとして知られており、臨床
試験において、再発/難治性の全身性未分化リンパ腫キ
ナーゼ(ALK)陽性未分化大細胞リンパ腫(ALCL)又は再
発/難治性のALK陽性切除不能炎症性筋線維芽細胞腫
(IMT)の小児患者の61%に報告されている。
・小児患者は視覚の変化を自発的に報告しない又は気づ
かないことがあるので、医療専門家は患者や家族/介護者
に視覚障害の症状や視力喪失のリスクを伝え、視覚障害
イギリス
や視力喪失が生じた場合には担当医に連絡するよう通知
する必要がある。
・小児患者は、視覚障害に関してモニタリングすべきであ
る。治療を開始する前にベースラインの眼科検査を行い、
その後1カ月以内、3カ月毎、新たな視覚障害が発生した場
合にフォローアップの検査を行う。
・小児患者では、グレード2の眼障害が発生した場合、減量
を検討する必要がある。また、グレード3又は4の眼障害で
は、他の原因が特定されない限り永久に中止する必要があ
る。
措置区分※1
本邦における措
置内容※2
情報提供
対応不要
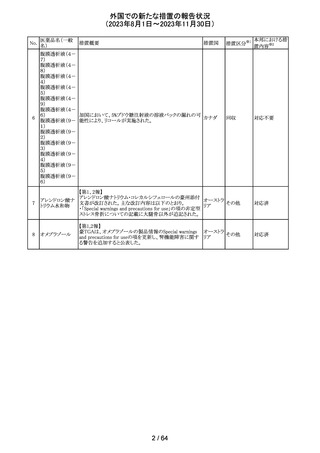
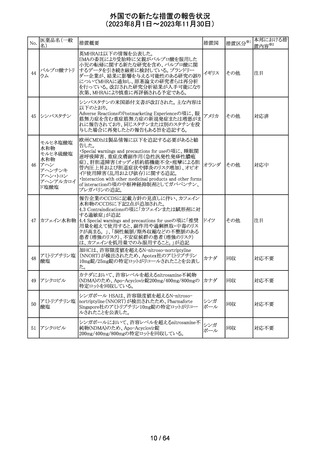
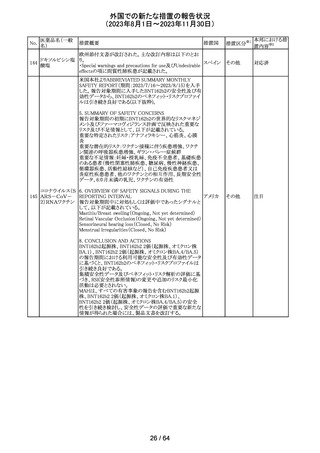
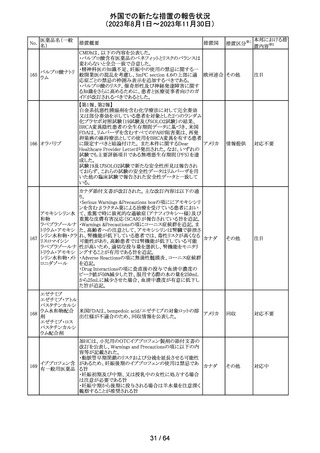
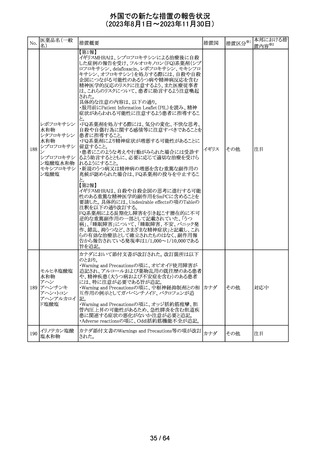
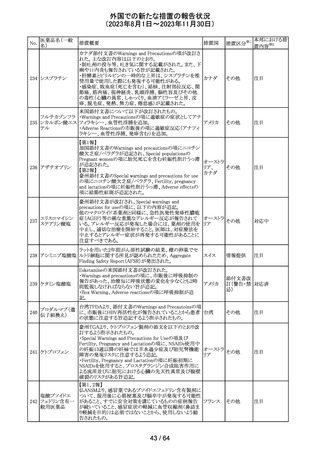
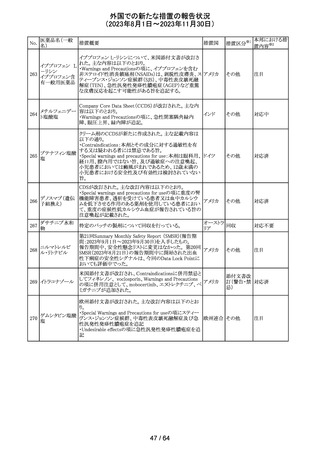
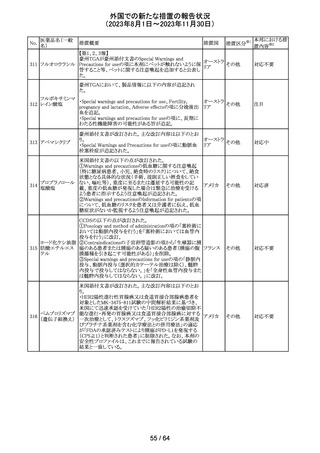
アセトアミノフェン
アセトアミノフェン ニュージーランドにおいて、パラセタモール含有製剤につ
含有一般用医薬 いて1パック当たりのパラセタモール含有量が10g超~50g ニュー
180 品
以下の液剤は薬局取扱薬から薬剤師取扱薬に再分類され ジーラン その他
トラマドール塩酸 たもの。なお、1パック当たり10g以下の液剤は薬局取扱薬 ド
塩・アセトアミノ
のままである。
フェン配合剤
対応不要
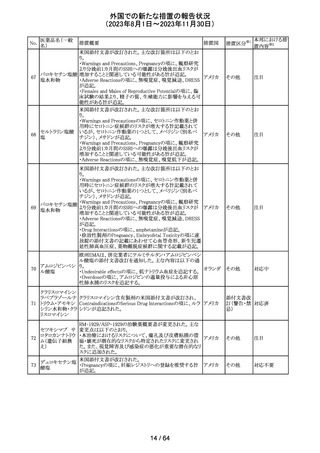
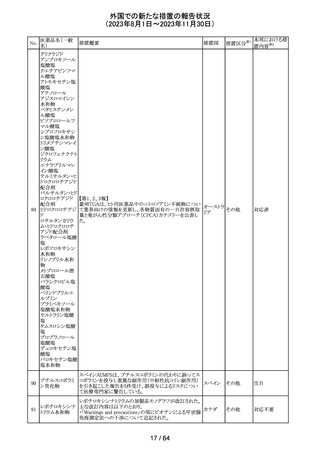
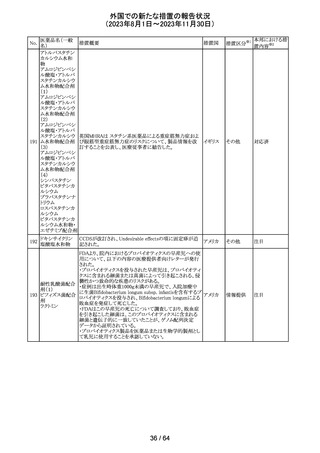
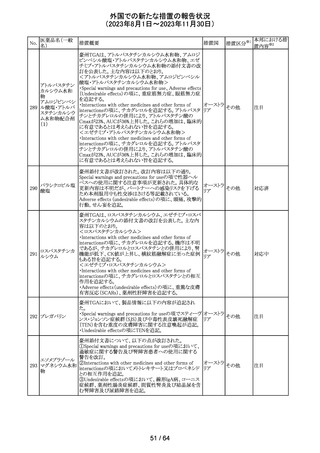
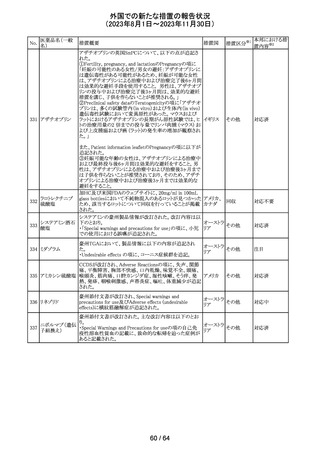
米国添付文書が改訂された。
インコボツリヌスト ・Warnings and Precautionsの項に、注射対象となる部位の
181
アメリカ
キシンA
筋力低下や萎縮がみられている場合には注意が必要であ
る旨が追記された。
その他
対応済
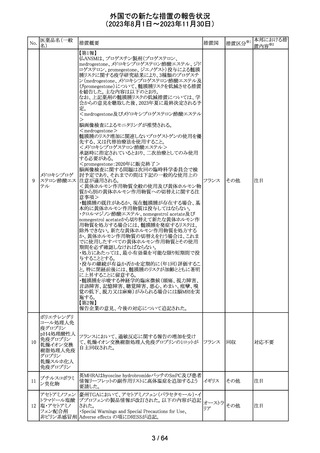
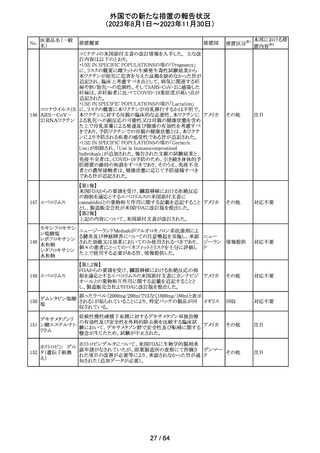
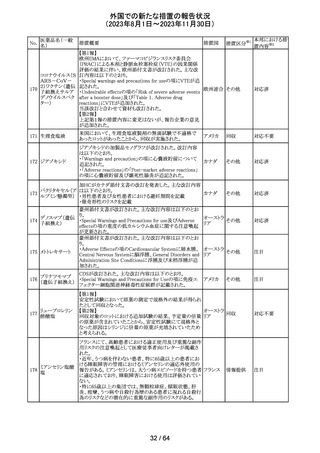
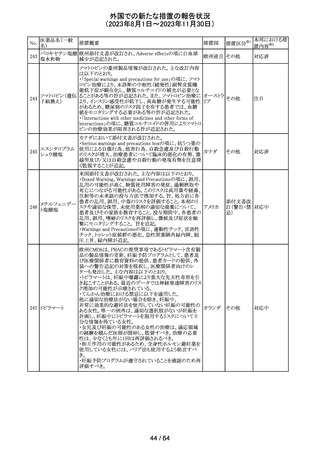
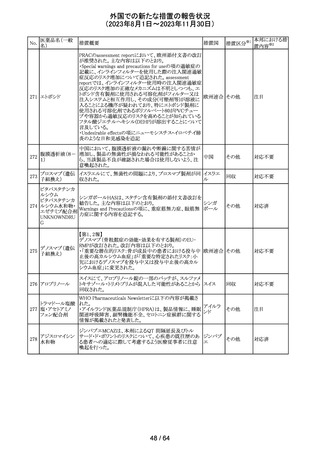
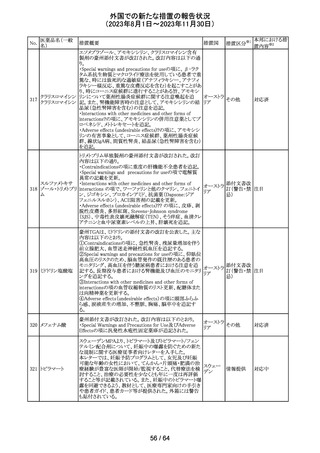
米国FDAより、本剤及びエクリズマブのすべての適応症に
関するREMSを修正するよう指示されたとのこと。
当該指示に至るFDAの懸念事項は以下のとおり。
(1)ACIPガイダンスを踏まえたワクチン接種又は抗菌薬の アメリカ
予防投与が行われていない患者における感染症
(2)患者がワクチン接種又は抗菌薬の予防投与が行われ
ているかの判断が困難であること。
その他
注目
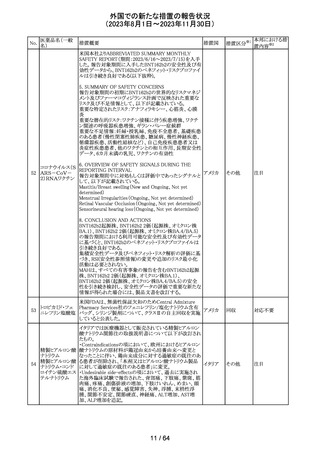
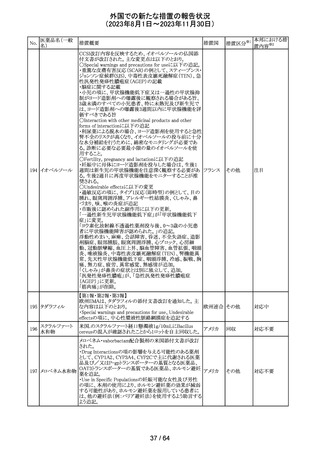
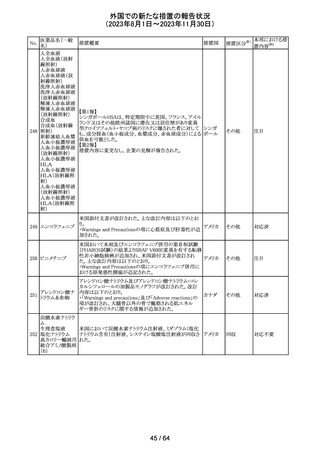
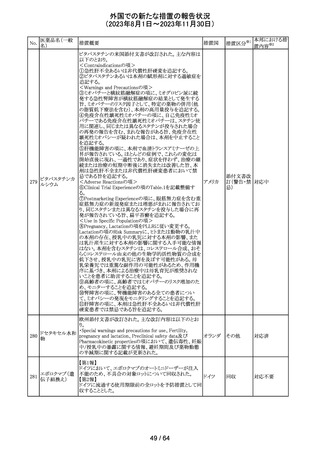
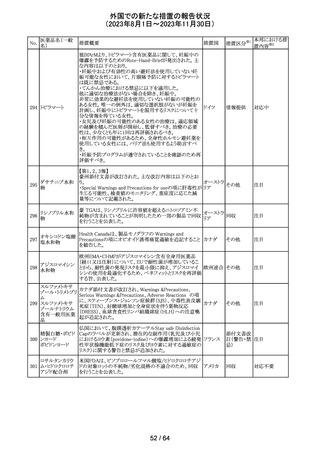
カナグリフロジン、ダパグリフロジン、bexagliflozin、エンパグ
リフロジン、ertugliflozinの米国添付文書が改訂された。改
ルセオグリフロジ
183
訂内容は以下のとおり。
アメリカ
ン水和物
・「Warnings and precautions」の項に糖尿病性ケトアシドー
シスに関する注意喚起が追記された。
その他
対応済
182
ラブリズマブ(遺
伝子組換え)
33 / 64
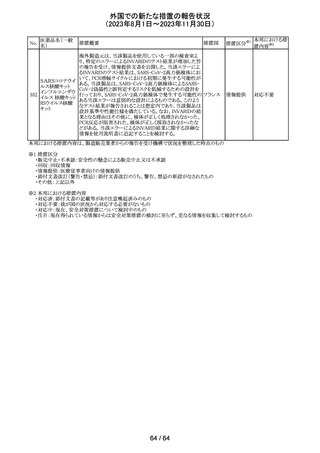
(2023年8月1日~2023年11月30日)
No.
医薬品名(一般
名)
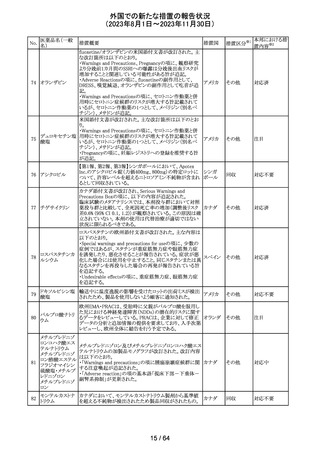
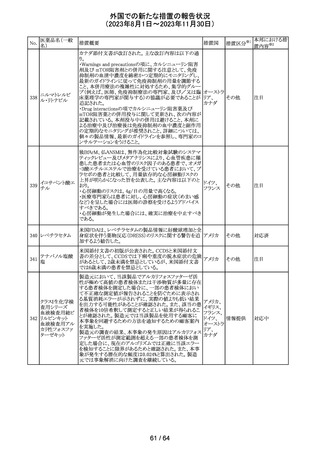
179 クリゾチニブ
措置概要
措置国
小児患者における視覚障害(視力喪失を含む)のモニタリ
ングの必要性が通知された。主な内容は以下のとおり。
・視覚障害はクリゾチニブのリスクとして知られており、臨床
試験において、再発/難治性の全身性未分化リンパ腫キ
ナーゼ(ALK)陽性未分化大細胞リンパ腫(ALCL)又は再
発/難治性のALK陽性切除不能炎症性筋線維芽細胞腫
(IMT)の小児患者の61%に報告されている。
・小児患者は視覚の変化を自発的に報告しない又は気づ
かないことがあるので、医療専門家は患者や家族/介護者
に視覚障害の症状や視力喪失のリスクを伝え、視覚障害
イギリス
や視力喪失が生じた場合には担当医に連絡するよう通知
する必要がある。
・小児患者は、視覚障害に関してモニタリングすべきであ
る。治療を開始する前にベースラインの眼科検査を行い、
その後1カ月以内、3カ月毎、新たな視覚障害が発生した場
合にフォローアップの検査を行う。
・小児患者では、グレード2の眼障害が発生した場合、減量
を検討する必要がある。また、グレード3又は4の眼障害で
は、他の原因が特定されない限り永久に中止する必要があ
る。
措置区分※1
本邦における措
置内容※2
情報提供
対応不要
アセトアミノフェン
アセトアミノフェン ニュージーランドにおいて、パラセタモール含有製剤につ
含有一般用医薬 いて1パック当たりのパラセタモール含有量が10g超~50g ニュー
180 品
以下の液剤は薬局取扱薬から薬剤師取扱薬に再分類され ジーラン その他
トラマドール塩酸 たもの。なお、1パック当たり10g以下の液剤は薬局取扱薬 ド
塩・アセトアミノ
のままである。
フェン配合剤
対応不要
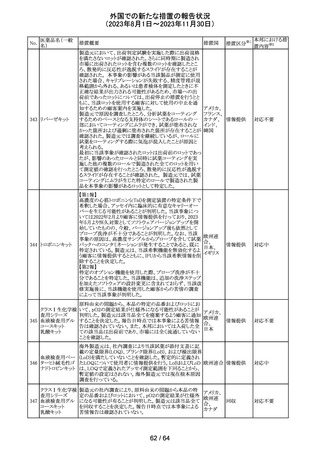
米国添付文書が改訂された。
インコボツリヌスト ・Warnings and Precautionsの項に、注射対象となる部位の
181
アメリカ
キシンA
筋力低下や萎縮がみられている場合には注意が必要であ
る旨が追記された。
その他
対応済
米国FDAより、本剤及びエクリズマブのすべての適応症に
関するREMSを修正するよう指示されたとのこと。
当該指示に至るFDAの懸念事項は以下のとおり。
(1)ACIPガイダンスを踏まえたワクチン接種又は抗菌薬の アメリカ
予防投与が行われていない患者における感染症
(2)患者がワクチン接種又は抗菌薬の予防投与が行われ
ているかの判断が困難であること。
その他
注目
カナグリフロジン、ダパグリフロジン、bexagliflozin、エンパグ
リフロジン、ertugliflozinの米国添付文書が改訂された。改
ルセオグリフロジ
183
訂内容は以下のとおり。
アメリカ
ン水和物
・「Warnings and precautions」の項に糖尿病性ケトアシドー
シスに関する注意喚起が追記された。
その他
対応済
182
ラブリズマブ(遺
伝子組換え)
33 / 64