よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況[1.1MB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第3回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
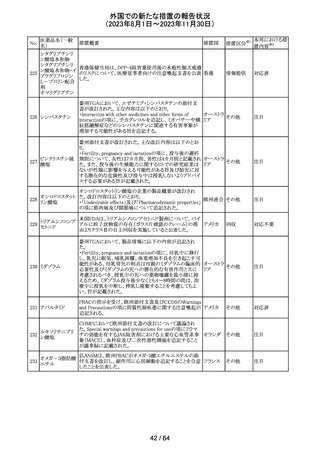
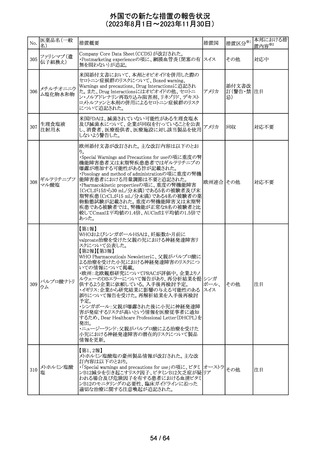
外国での新たな措置の報告状況
(2023年8月1日~2023年11月30日)
措置区分※1
本邦における措
置内容※2
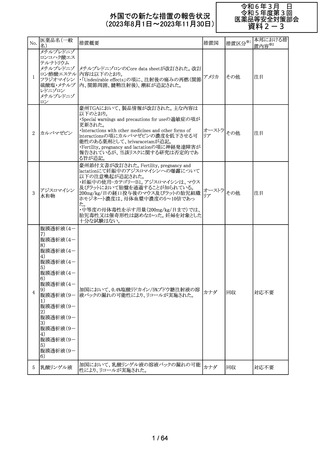
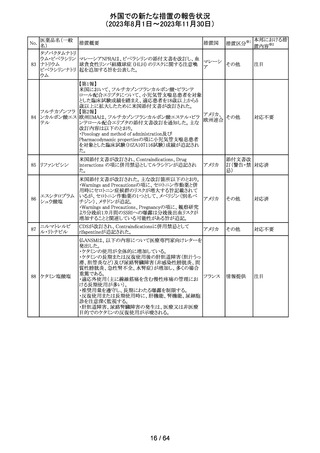
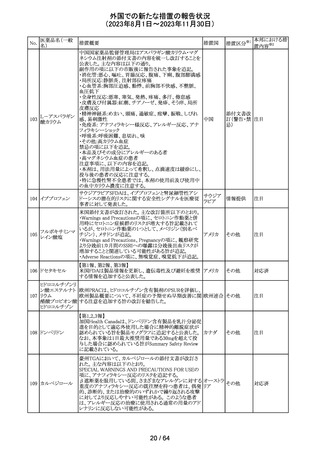
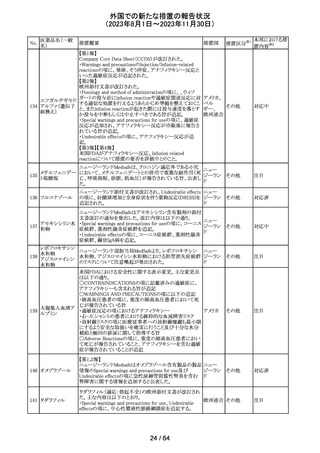
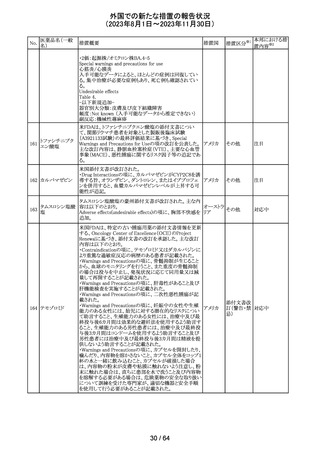
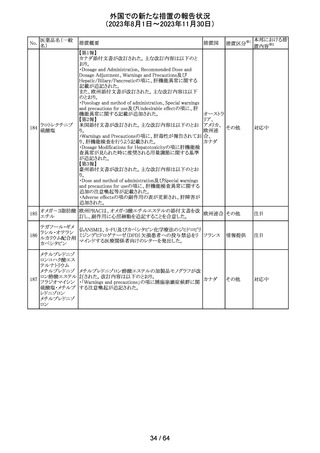
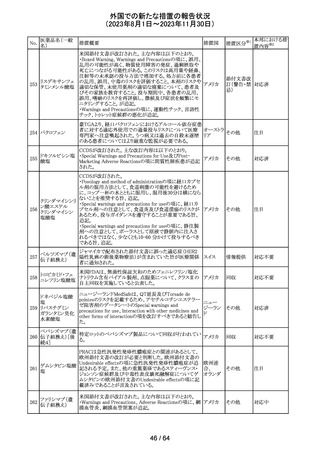
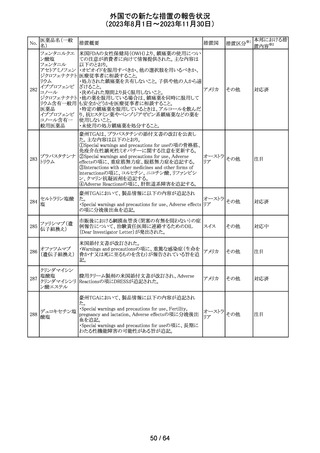
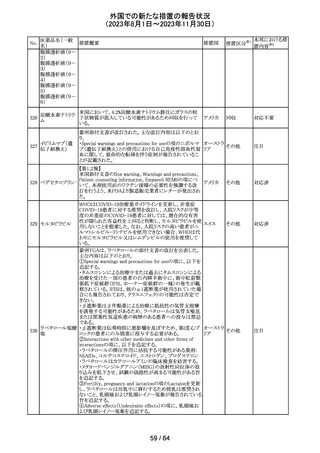
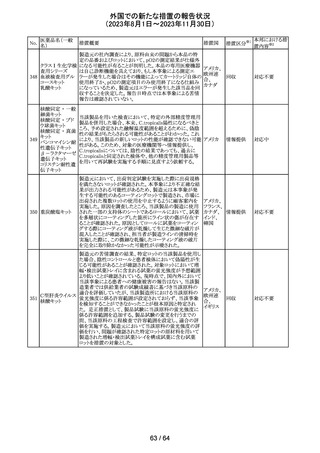
米国添付文書が改訂された。主な改訂箇所以下のとおり。
・Warnings and Precautions、Drug Interactionsの項に、セ
ロトニン作動薬と併用時にセロトニン症候群のリスクが増大
する旨記載されているが、セロトニン作動薬の1つとして、メ
ペリジン(別名ペチジン)、メサドンが追記。
ミルナシプラン塩
110
・Drug Interactionsの項に、抗血小板薬又は抗凝固薬との アメリカ
酸塩
併用で、出血のリスクが高まる可能性がある旨追記。
・Warnings and Precautions、Pregnancyの項に、観察研究
より分娩前1カ月間のSSRIへの曝露は分娩後出血リスクが
増加することと関連している可能性がある旨が追記。
・Adverse Reactionsの項に、無嗅覚症、嗅覚低下が追記。
その他
注目
ベンジルペニシリ
米国添付文書が改訂され、Adverse Reactionsの項に、
111 ンベンザチン水
コーニス症候群が追記された。
和物
その他
注目
情報提供
注目
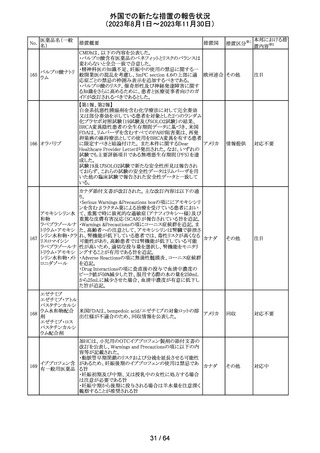
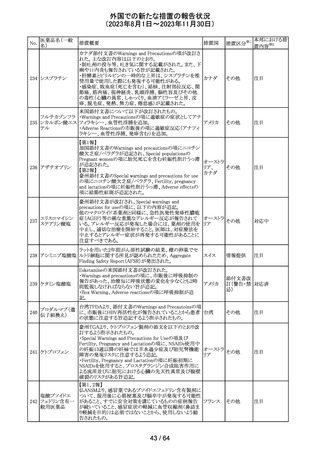
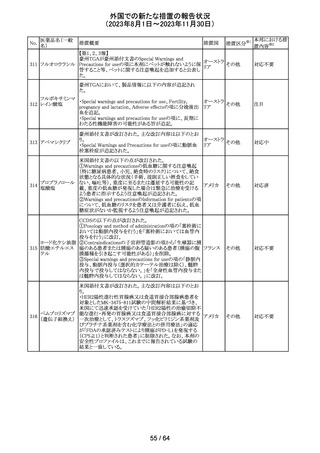
No.
医薬品名(一般
名)
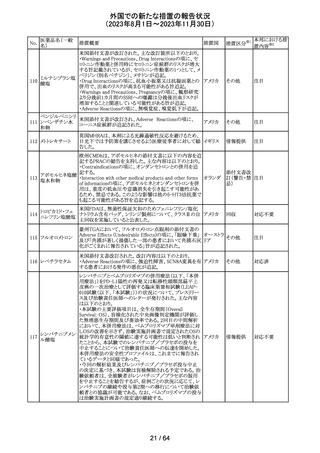
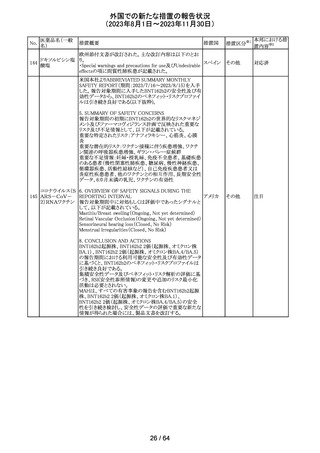
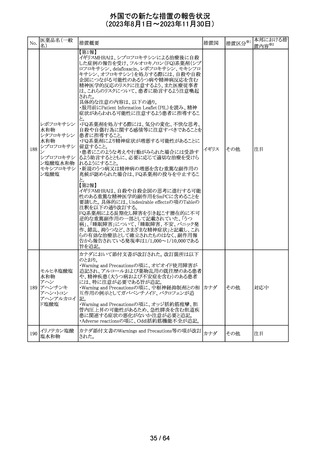
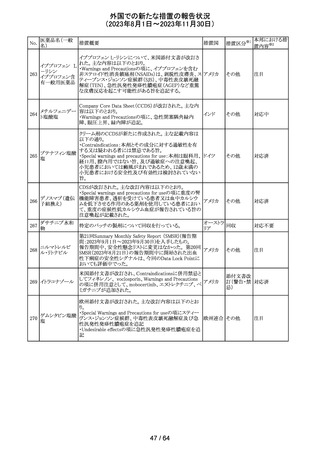
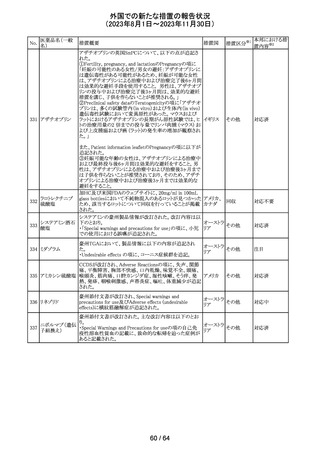
112 メトトレキサート
措置概要
措置国
アメリカ
英国MHRAは、本剤による光線過敏性反応を避けるため、
日光下では予防策を講じさせるよう医療従事者に対して勧 イギリス
告した。
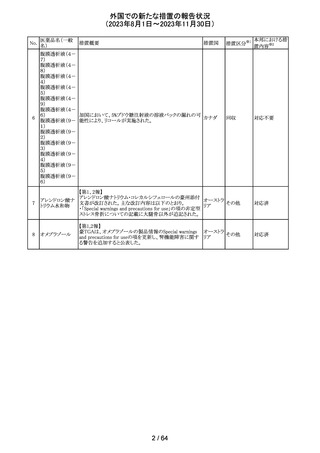
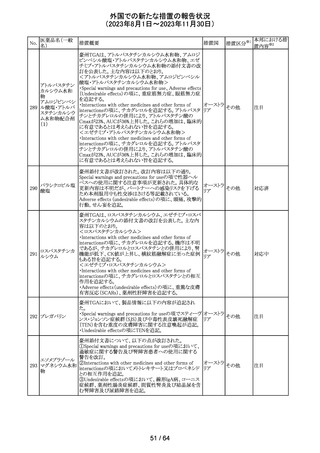
欧州CMDhは、アポモルヒネの添付文書に以下の内容を追
記するPRACの勧告を支持した。主な内容は以下のとおり。
・Contraindicationsの項に、オンダンセトロンとの併用を追
記する。
添付文書改
アポモルヒネ塩酸
113
・Interaction with other medical products and other forms オランダ 訂(警告・禁 注目
塩水和物
of informationの項に、アポモルヒネとオンダンセトロンを併
忌)
用は、重度の低血圧や意識消失を引き起こす可能性があ
るため、禁忌である。このような影響は他の5-HT3拮抗薬で
も起こる可能性がある旨を追記する。
114
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化
トロピカミド・フェ
ナトリウム含有バッグ、シリンジ製剤について、クラスⅡの自 アメリカ
ニレフリン塩酸塩
主回収を実施していると公表した。
回収
対応不要
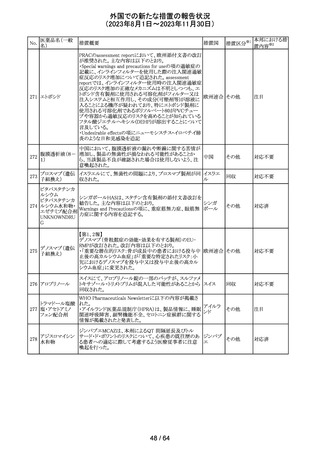
115 フルオロメトロン
豪州TGAにおいて、フルオロメトロン点眼剤の添付文書の
Adverse Effects (Undesirable Effects)の項に、「眼瞼下垂」 オーストラ
その他
及び「角膜が著しく損傷した一部の患者において角膜石灰 リア
化がごくまれに報告されている」旨が追記された。
注目
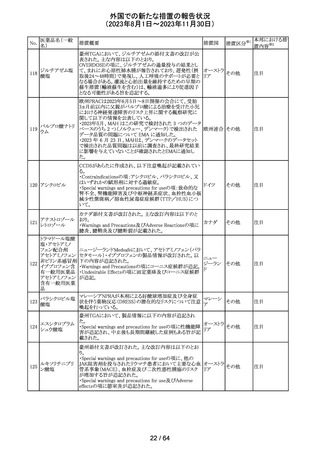
116 レベチラセタム
米国添付文書改訂された。改訂内容は以下のとおり。
・Adverse Reactionsの項に、強迫性障害、SCN8A変異を有 アメリカ
する患者における発作の悪化が追記。
その他
対応済
情報提供
対応不要
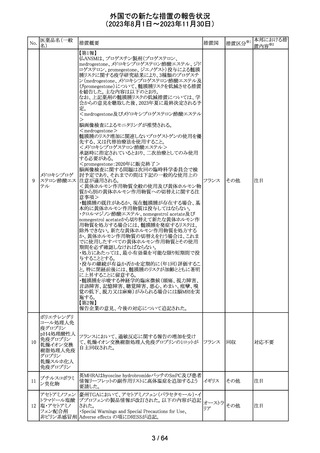
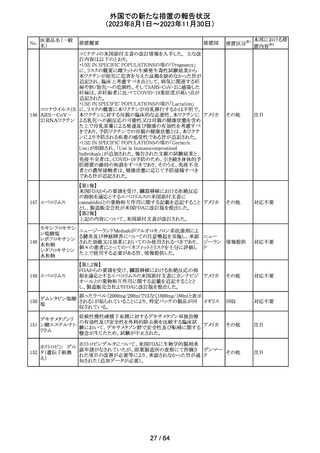
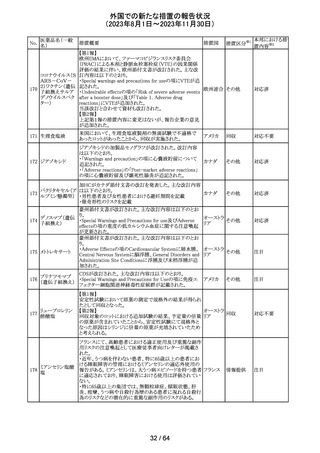
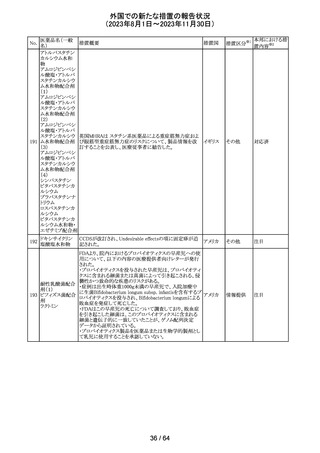
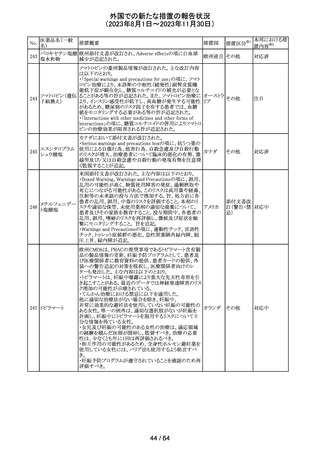
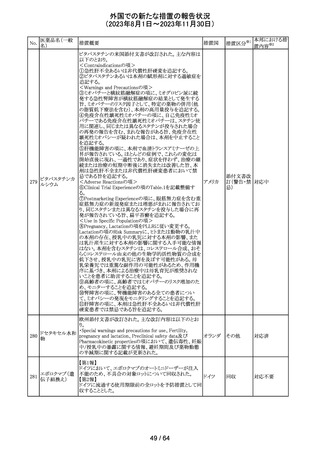
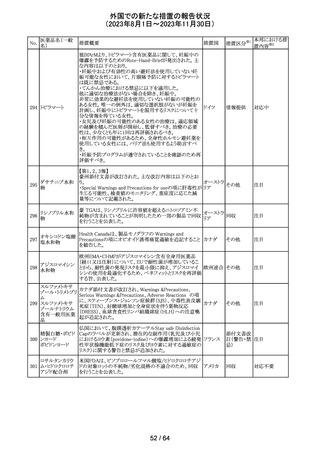
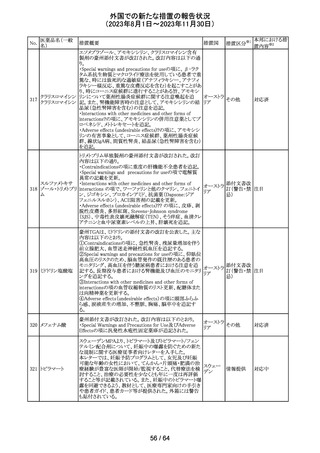
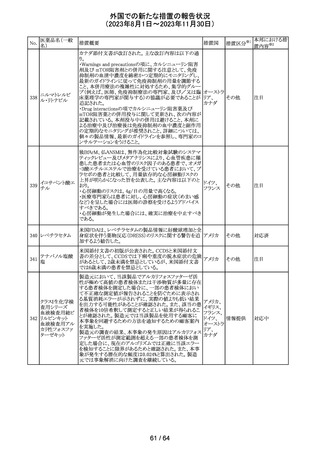
レンバチニブとペムブロリズマブの併用療法(以下、「本併
用療法」)をPD-L1陽性の再発又は転移性頭頸部扁平上
皮癌の一次治療として評価する臨床第Ⅲ相試験(LEAP010試験(以下、「本試験」))の状況について、プレスリリー
ス及び治験責任医師へのレターが発行された。主な内容
は以下のとおり。
・本試験の主要評価項目は、全生存期間(Overall
Survival: OS)、盲検化された中央画像判定機関が評価し
た無増悪生存期間及び奏効率である。2回目の中間解析
において、本併用療法は、ペムブロリズマブ単剤療法に対
しOSの改善を示さず、治験実施計画書で規定されたOSの
レンバチニブメシ
117
統計学的有意性の閾値に達する可能性は低いと判断され アメリカ
ル酸塩
たことから、本試験でのレンバチニブ/プラセボの投与を
中止することについて治験責任医師への伝達を開始した。
本併用療法の安全性プロファイルは、これまでに報告され
ているデータと同様であった。
・今回の解析結果及びレンバチニブ/プラセボ投与中止
の決定に基づき、本試験は盲検解除される予定である。治
験依頼者は、全被験者がレンバチニブ/プラセボの服用
を中止することを勧告するが、症例ごとの状況に応じて、レ
ンバチニブの継続や投与第2期への移行について治験依
頼者との協議が可能である。なお、ペムブロリズマブの投与
は治験実施計画書の規定通り継続する。
21 / 64
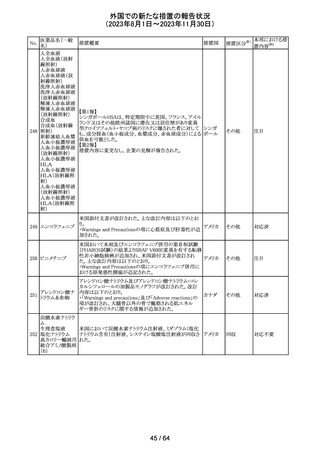
(2023年8月1日~2023年11月30日)
措置区分※1
本邦における措
置内容※2
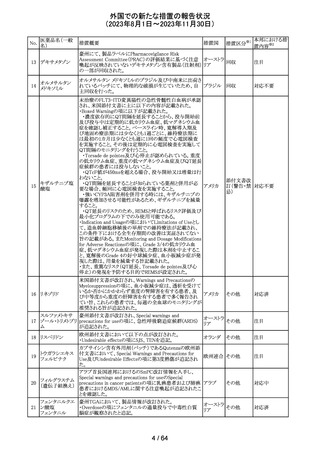
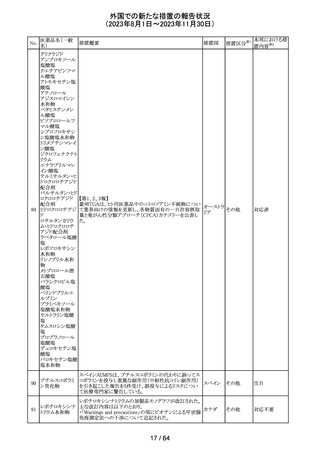
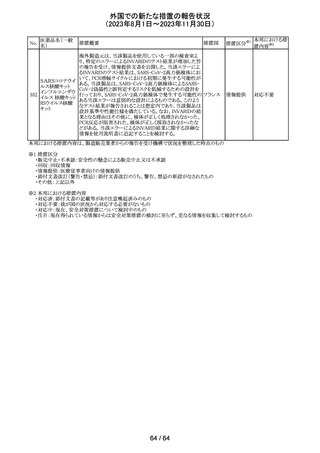
米国添付文書が改訂された。主な改訂箇所以下のとおり。
・Warnings and Precautions、Drug Interactionsの項に、セ
ロトニン作動薬と併用時にセロトニン症候群のリスクが増大
する旨記載されているが、セロトニン作動薬の1つとして、メ
ペリジン(別名ペチジン)、メサドンが追記。
ミルナシプラン塩
110
・Drug Interactionsの項に、抗血小板薬又は抗凝固薬との アメリカ
酸塩
併用で、出血のリスクが高まる可能性がある旨追記。
・Warnings and Precautions、Pregnancyの項に、観察研究
より分娩前1カ月間のSSRIへの曝露は分娩後出血リスクが
増加することと関連している可能性がある旨が追記。
・Adverse Reactionsの項に、無嗅覚症、嗅覚低下が追記。
その他
注目
ベンジルペニシリ
米国添付文書が改訂され、Adverse Reactionsの項に、
111 ンベンザチン水
コーニス症候群が追記された。
和物
その他
注目
情報提供
注目
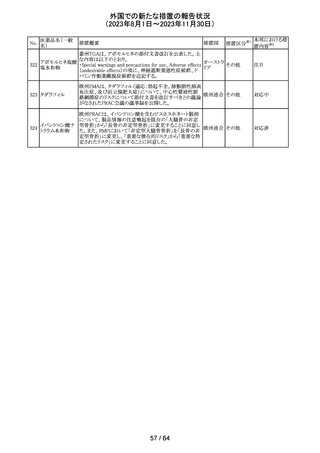
No.
医薬品名(一般
名)
112 メトトレキサート
措置概要
措置国
アメリカ
英国MHRAは、本剤による光線過敏性反応を避けるため、
日光下では予防策を講じさせるよう医療従事者に対して勧 イギリス
告した。
欧州CMDhは、アポモルヒネの添付文書に以下の内容を追
記するPRACの勧告を支持した。主な内容は以下のとおり。
・Contraindicationsの項に、オンダンセトロンとの併用を追
記する。
添付文書改
アポモルヒネ塩酸
113
・Interaction with other medical products and other forms オランダ 訂(警告・禁 注目
塩水和物
of informationの項に、アポモルヒネとオンダンセトロンを併
忌)
用は、重度の低血圧や意識消失を引き起こす可能性があ
るため、禁忌である。このような影響は他の5-HT3拮抗薬で
も起こる可能性がある旨を追記する。
114
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化
トロピカミド・フェ
ナトリウム含有バッグ、シリンジ製剤について、クラスⅡの自 アメリカ
ニレフリン塩酸塩
主回収を実施していると公表した。
回収
対応不要
115 フルオロメトロン
豪州TGAにおいて、フルオロメトロン点眼剤の添付文書の
Adverse Effects (Undesirable Effects)の項に、「眼瞼下垂」 オーストラ
その他
及び「角膜が著しく損傷した一部の患者において角膜石灰 リア
化がごくまれに報告されている」旨が追記された。
注目
116 レベチラセタム
米国添付文書改訂された。改訂内容は以下のとおり。
・Adverse Reactionsの項に、強迫性障害、SCN8A変異を有 アメリカ
する患者における発作の悪化が追記。
その他
対応済
情報提供
対応不要
レンバチニブとペムブロリズマブの併用療法(以下、「本併
用療法」)をPD-L1陽性の再発又は転移性頭頸部扁平上
皮癌の一次治療として評価する臨床第Ⅲ相試験(LEAP010試験(以下、「本試験」))の状況について、プレスリリー
ス及び治験責任医師へのレターが発行された。主な内容
は以下のとおり。
・本試験の主要評価項目は、全生存期間(Overall
Survival: OS)、盲検化された中央画像判定機関が評価し
た無増悪生存期間及び奏効率である。2回目の中間解析
において、本併用療法は、ペムブロリズマブ単剤療法に対
しOSの改善を示さず、治験実施計画書で規定されたOSの
レンバチニブメシ
117
統計学的有意性の閾値に達する可能性は低いと判断され アメリカ
ル酸塩
たことから、本試験でのレンバチニブ/プラセボの投与を
中止することについて治験責任医師への伝達を開始した。
本併用療法の安全性プロファイルは、これまでに報告され
ているデータと同様であった。
・今回の解析結果及びレンバチニブ/プラセボ投与中止
の決定に基づき、本試験は盲検解除される予定である。治
験依頼者は、全被験者がレンバチニブ/プラセボの服用
を中止することを勧告するが、症例ごとの状況に応じて、レ
ンバチニブの継続や投与第2期への移行について治験依
頼者との協議が可能である。なお、ペムブロリズマブの投与
は治験実施計画書の規定通り継続する。
21 / 64