よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件に係る取扱いについて (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
クョ
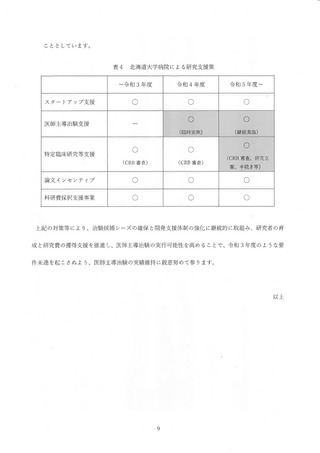
(過去 3年間)
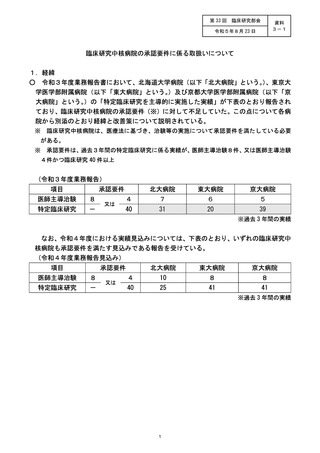
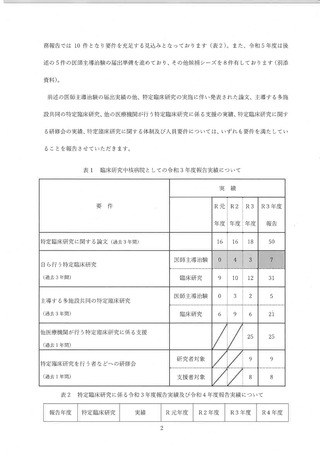
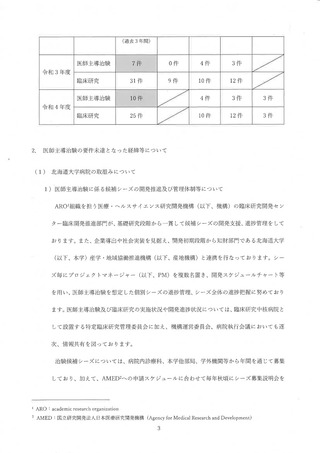
医師主導治験 7 件 0 件 4 件 3 件
令和3年度
目床研究 31 件 9 件 10 件 12 件
医師主導治験 10 件 4 件 8 8 御
令和 4 年度
孔床研究 gl作 10 件 12 件 3 件
医師主導治験の要件未達となった経緯等について
1
(1) 北海道大学病院の取組みについて
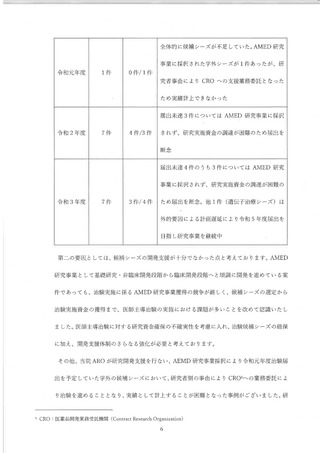
) 医師主導治験に係る候補シーズの開発推進及び管理体制等について
ARO'組織を担う医療・ヘルスサイエンス研究開発機構 (以下、擁構) の臨床研究開発セン
ター了臨床開発推進部門が、 基礎研究段階から一貫して候補シーズの開発支援、 進和管理をして
おります。 また、企業導出や社会実装を見据え、 開発初期段階から知財部門である北海道大学
(以下、 本学) 産学・地域協働推進機構 (以下、 産地機構) と連携を行なっております。シー
ズ毎にプロジェクトマネージャー (以下、PM) を複数名置き、開発スケジュールチャート等
を用い、 医師主導治験を想定した個別シーズの進捗管理、シーズ全体の進捗把握に努めており
ます。 医師主導治験及び臨床研究の実施状況や開発進捗状況については、 臨床研究中核病院と
して設置する特定臨床研究管理委員会に加え、機構運営委員会、病院執行会議においても乏
次、情報共有を図っております。
治験候補シーズについては、病院内診療科、本学他部局、学外機関等から年間を通じて募集
しており、加えて、AMED2への申請スケジュールに合わせて毎年秋頃にシーズ募集説明会を
1 ARO : academic research organ1zation
2 AMED : 国立研究開発法人日本医療研究開発機構 (Agency for Medical Research and Development)
3
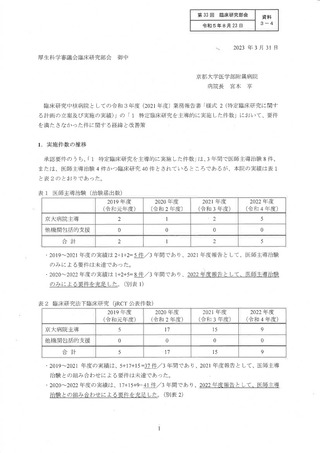
(過去 3年間)
医師主導治験 7 件 0 件 4 件 3 件
令和3年度
目床研究 31 件 9 件 10 件 12 件
医師主導治験 10 件 4 件 8 8 御
令和 4 年度
孔床研究 gl作 10 件 12 件 3 件
医師主導治験の要件未達となった経緯等について
1
(1) 北海道大学病院の取組みについて
) 医師主導治験に係る候補シーズの開発推進及び管理体制等について
ARO'組織を担う医療・ヘルスサイエンス研究開発機構 (以下、擁構) の臨床研究開発セン
ター了臨床開発推進部門が、 基礎研究段階から一貫して候補シーズの開発支援、 進和管理をして
おります。 また、企業導出や社会実装を見据え、 開発初期段階から知財部門である北海道大学
(以下、 本学) 産学・地域協働推進機構 (以下、 産地機構) と連携を行なっております。シー
ズ毎にプロジェクトマネージャー (以下、PM) を複数名置き、開発スケジュールチャート等
を用い、 医師主導治験を想定した個別シーズの進捗管理、シーズ全体の進捗把握に努めており
ます。 医師主導治験及び臨床研究の実施状況や開発進捗状況については、 臨床研究中核病院と
して設置する特定臨床研究管理委員会に加え、機構運営委員会、病院執行会議においても乏
次、情報共有を図っております。
治験候補シーズについては、病院内診療科、本学他部局、学外機関等から年間を通じて募集
しており、加えて、AMED2への申請スケジュールに合わせて毎年秋頃にシーズ募集説明会を
1 ARO : academic research organ1zation
2 AMED : 国立研究開発法人日本医療研究開発機構 (Agency for Medical Research and Development)
3