よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件に係る取扱いについて (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第 33 回
臨床研究部会
資料
3-1
令和5年8月 23 日
臨床研究中核病院の承認要件に係る取扱いについて
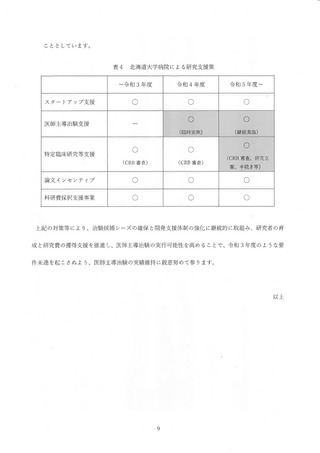
1.経緯
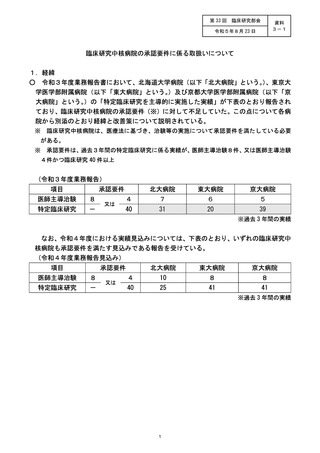
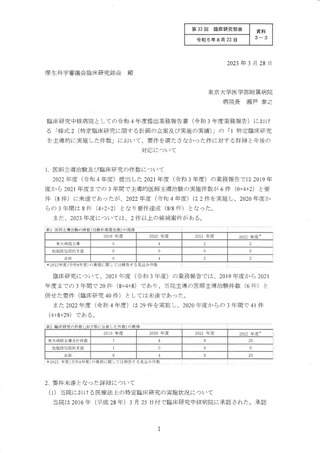
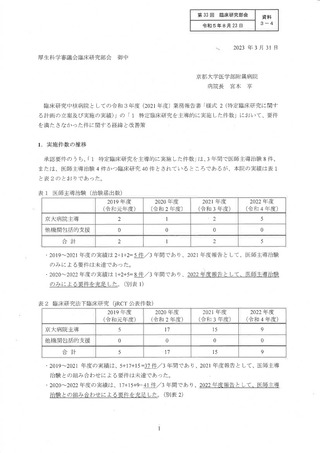
○ 令和3年度業務報告書において、北海道大学病院(以下「北大病院」という。)、東京大
学医学部附属病院(以下「東大病院」という。)及び京都大学医学部附属病院(以下「京
大病院」という。)の「特定臨床研究を主導的に実施した実績」が下表のとおり報告され
ており、臨床研究中核病院の承認要件(※)に対して不足していた。この点について各病
院から別添のとおり経緯と改善策について説明されている。
※
臨床研究中核病院は、医療法に基づき、治験等の実施について承認要件を満たしている必要
がある。
※
承認要件は、過去3年間の特定臨床研究に係る実績が、医師主導治験8件、又は医師主導治験
4件かつ臨床研究 40 件以上
(令和3年度業務報告)
項目
承認要件
医師主導治験
8
特定臨床研究
-
又は
北大病院
東大病院
京大病院
4
7
6
5
40
31
20
39
※過去 3 年間の実績
なお、令和4年度における実績見込みについては、下表のとおり、いずれの臨床研究中
核病院も承認要件を満たす見込みである報告を受けている。
(令和4年度業務報告見込み)
項目
承認要件
医師主導治験
8
特定臨床研究
-
又は
北大病院
東大病院
京大病院
4
10
8
8
40
25
41
41
※過去 3 年間の実績
1
臨床研究部会
資料
3-1
令和5年8月 23 日
臨床研究中核病院の承認要件に係る取扱いについて
1.経緯
○ 令和3年度業務報告書において、北海道大学病院(以下「北大病院」という。)、東京大
学医学部附属病院(以下「東大病院」という。)及び京都大学医学部附属病院(以下「京
大病院」という。)の「特定臨床研究を主導的に実施した実績」が下表のとおり報告され
ており、臨床研究中核病院の承認要件(※)に対して不足していた。この点について各病
院から別添のとおり経緯と改善策について説明されている。
※
臨床研究中核病院は、医療法に基づき、治験等の実施について承認要件を満たしている必要
がある。
※
承認要件は、過去3年間の特定臨床研究に係る実績が、医師主導治験8件、又は医師主導治験
4件かつ臨床研究 40 件以上
(令和3年度業務報告)
項目
承認要件
医師主導治験
8
特定臨床研究
-
又は
北大病院
東大病院
京大病院
4
7
6
5
40
31
20
39
※過去 3 年間の実績
なお、令和4年度における実績見込みについては、下表のとおり、いずれの臨床研究中
核病院も承認要件を満たす見込みである報告を受けている。
(令和4年度業務報告見込み)
項目
承認要件
医師主導治験
8
特定臨床研究
-
又は
北大病院
東大病院
京大病院
4
10
8
8
40
25
41
41
※過去 3 年間の実績
1