よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件に係る取扱いについて (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
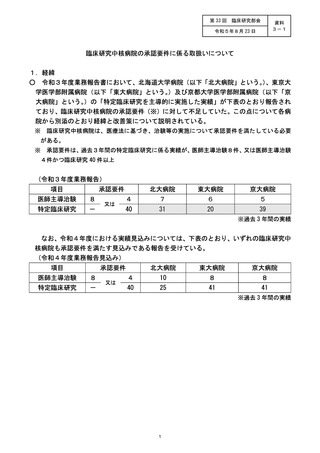
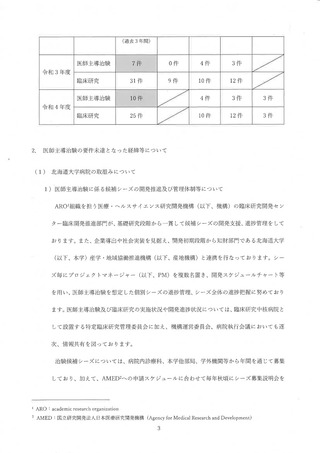
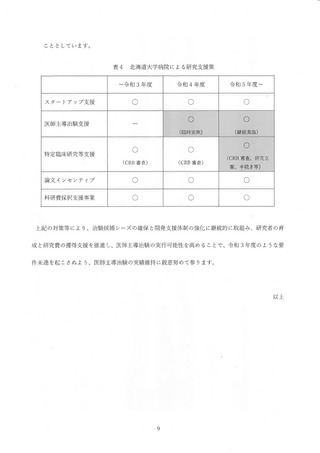
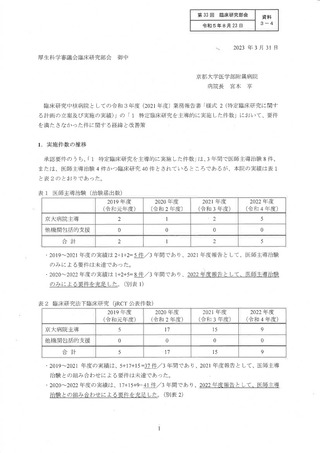
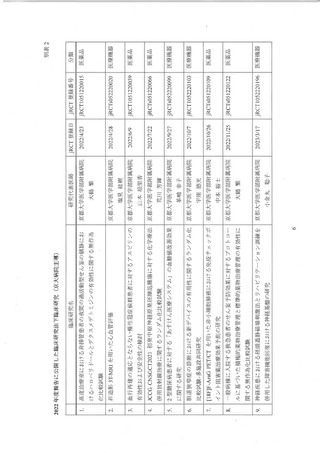
時、2012 年度から 2014 年度までの 3 年間の実績は、医師主導治験 3 件 (要件4 件)、
呈床研究 81 件 (要件 80 件) で、了臨床研究の要件を充足することで承認された。 当院
は国立大学病院のデータベースセンターによる全国立大学病院を対象とした調査にお
いて医学研究の英語論文数では全国立大学病院の中でも最上位を競っているが、医療
法上の特定臨床研究数においては必ずしも最上位にはなく、特に、医師主導治験の件
数は他拠点に比しても少ない傾向にあった。
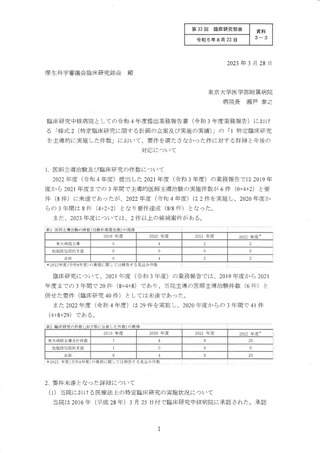
しかしながら、了臨床研究中核病院に承認された後、2014 年に制定された「人を対象
とする医学系研究に関する倫理指針」の影響で、全国的にも臨床研究数が減じた影
が当院にも及んだこと、それに加えて当時大きな社会問題ともなった臨床研究に関す
る不適正事案について、当院において生じたものもあり、了臨床研究を実施しようとす
る研究者に対して、少なかからずネガティブな影響を与えたこと、2016 年度に新規診療
等検討委員会が設置され、適応外の探索的な介入研究と して実施されていたものが医
療と して実施され、観宗研究と して発表することが可能となったこと等の影響によ
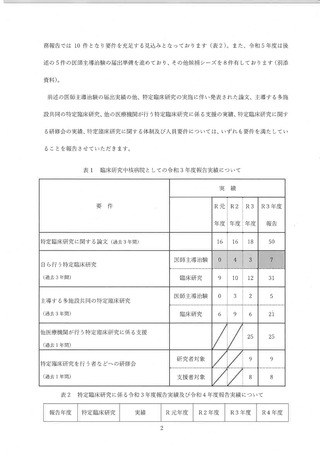
り、医師主導治験以外の臨床研究数が減少傾向となった。 承認後の臨床研究について
は、毎年度実施件数が減じ、80 件に達することはなく、また、2018 年度に臨床研究法
が施行されてからは、年間の実施件数が 1 桁に留まるところとなった。一方、医師主
導治験については、2011 年度に厚生労働省の早期・探索的臨床試験拠点整備事業にお
いて精神・神経分野の拠点と して選定された後、First-in-Human 試験を実施可能な臨床
試験専用病床である P1 ユニットを整備し、そこを活用 した医師主導治険を実施するな
ど、東大病院においても医師主導治験の実施を増やす取り組みを行い、了臨床研究中核
病院の承認要件は医師主導治験の方の要件で充足してきた。
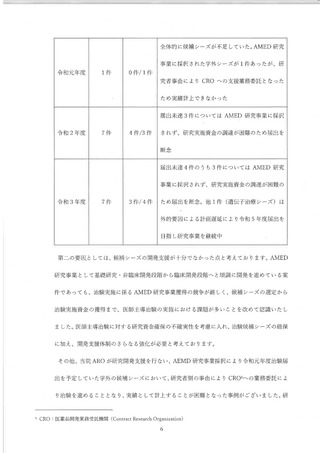
医師主導治験以外の了臨床研究が減少している傾向を改善し、医師主導治験を含めて
呈床研究を総合的に推進することを目指し、2019 年 12 月 1 日に、了臨床研究支援セン
ターを臨床研究推進センターに名称を改称し、上臨床研究法施行等に対応し、ユーザー
である医師・研究者や企業及び患者に分かりやすい組織とするため8部門に再編し、
それぞれのユーザーの窓口をソンストップ化すること、病院内の人材を一層活用する
ために薬剤部等との連携を強化することにより、了臨床研究を推進する組織と した。
組織再編後、臨床研究に関するアイデアを気軽に相談できるようにするための取り
組みとして、研究者主導試験推進部門の研究者主導試験総合事務局を窓口として、学
内外の研究者からの様々な質問・相談に対応するワンストップ和相談を開始した。揚談
は約 1 時間 (無料) で、相談内容に応じて専門知識を有する最も適当な応対者を選ん
で対応した。的確な助言をするために、応対者は臨床研究推進センターのメンバーに
限ることなく、外部の有識者をエキスパートパネル (例えば PMDA で医療機器の審査
経験のある者) として招際した。また組織として適切な回答をするために、例えば先
進医療に関する相談に際しては、センター内で事前に打ち合わせを行った。 特定臨床
研究、および特定臨床研究以外の介入研究を計画する研究者に対して計画立案支援
呈床研究 81 件 (要件 80 件) で、了臨床研究の要件を充足することで承認された。 当院
は国立大学病院のデータベースセンターによる全国立大学病院を対象とした調査にお
いて医学研究の英語論文数では全国立大学病院の中でも最上位を競っているが、医療
法上の特定臨床研究数においては必ずしも最上位にはなく、特に、医師主導治験の件
数は他拠点に比しても少ない傾向にあった。
しかしながら、了臨床研究中核病院に承認された後、2014 年に制定された「人を対象
とする医学系研究に関する倫理指針」の影響で、全国的にも臨床研究数が減じた影
が当院にも及んだこと、それに加えて当時大きな社会問題ともなった臨床研究に関す
る不適正事案について、当院において生じたものもあり、了臨床研究を実施しようとす
る研究者に対して、少なかからずネガティブな影響を与えたこと、2016 年度に新規診療
等検討委員会が設置され、適応外の探索的な介入研究と して実施されていたものが医
療と して実施され、観宗研究と して発表することが可能となったこと等の影響によ
り、医師主導治験以外の臨床研究数が減少傾向となった。 承認後の臨床研究について
は、毎年度実施件数が減じ、80 件に達することはなく、また、2018 年度に臨床研究法
が施行されてからは、年間の実施件数が 1 桁に留まるところとなった。一方、医師主
導治験については、2011 年度に厚生労働省の早期・探索的臨床試験拠点整備事業にお
いて精神・神経分野の拠点と して選定された後、First-in-Human 試験を実施可能な臨床
試験専用病床である P1 ユニットを整備し、そこを活用 した医師主導治険を実施するな
ど、東大病院においても医師主導治験の実施を増やす取り組みを行い、了臨床研究中核
病院の承認要件は医師主導治験の方の要件で充足してきた。
医師主導治験以外の了臨床研究が減少している傾向を改善し、医師主導治験を含めて
呈床研究を総合的に推進することを目指し、2019 年 12 月 1 日に、了臨床研究支援セン
ターを臨床研究推進センターに名称を改称し、上臨床研究法施行等に対応し、ユーザー
である医師・研究者や企業及び患者に分かりやすい組織とするため8部門に再編し、
それぞれのユーザーの窓口をソンストップ化すること、病院内の人材を一層活用する
ために薬剤部等との連携を強化することにより、了臨床研究を推進する組織と した。
組織再編後、臨床研究に関するアイデアを気軽に相談できるようにするための取り
組みとして、研究者主導試験推進部門の研究者主導試験総合事務局を窓口として、学
内外の研究者からの様々な質問・相談に対応するワンストップ和相談を開始した。揚談
は約 1 時間 (無料) で、相談内容に応じて専門知識を有する最も適当な応対者を選ん
で対応した。的確な助言をするために、応対者は臨床研究推進センターのメンバーに
限ることなく、外部の有識者をエキスパートパネル (例えば PMDA で医療機器の審査
経験のある者) として招際した。また組織として適切な回答をするために、例えば先
進医療に関する相談に際しては、センター内で事前に打ち合わせを行った。 特定臨床
研究、および特定臨床研究以外の介入研究を計画する研究者に対して計画立案支援