よむ、つかう、まなぶ。
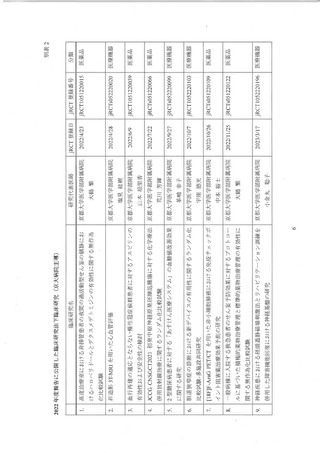
資料3:臨床研究中核病院の承認要件に係る取扱いについて (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
AMED 申請等の競争的研究資金獲得に関する研究者向けにセミナーを新たに実施しました。こて
れらの取組みについては、継続的に実施むするとともに、不断の見次しと新たな対策の検討を講じ
るととで、治験シーズの更なる確保に努めて参ります。
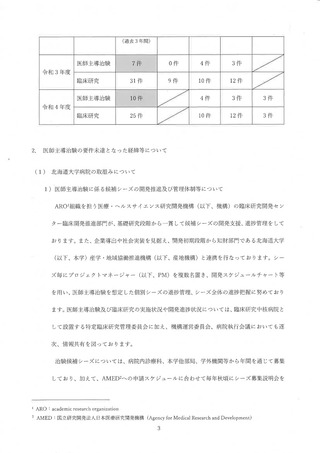
支援体制の強化のため、令和 4 年度に臨床開発推進部門に6名 (製薬企業での研究開発業務経
験者1名 (教授)、 PMDA 審査業務経験者 1 名、他教員2名 (医師 1 名、 歯科医師 1 名)、スタデ
ィーマネージャー (以下、SM) 2 名) を採用しました。また、AMED 生物統計家育成支援事業
の大学修士課程修了者 2名を採用し、 生物統計家部門について$体制を強化しました。令和 5 年
度に2.(1) 2) 人材育成に係る取組みとして教員2名 (医師2名) を新たに採用する予定とし
ており、さらなる強化を図ります。
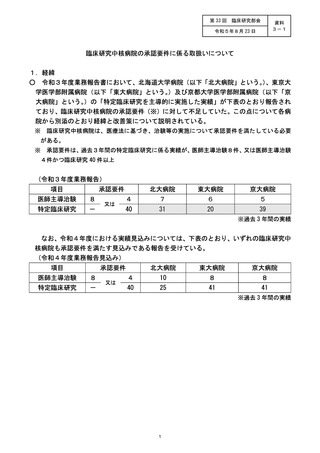
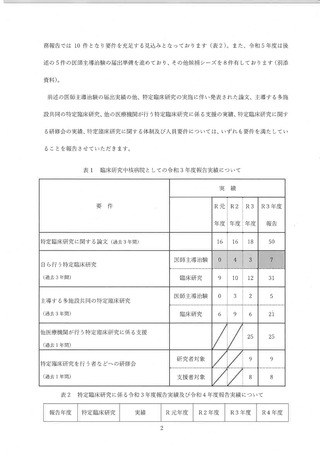
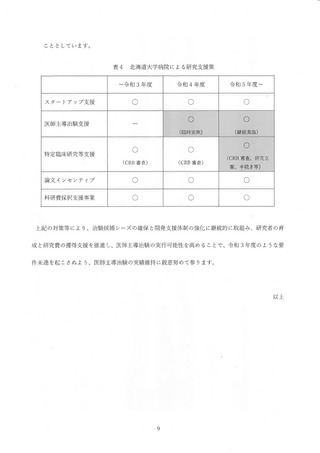
(2) 病院しての研究支援策等の拡充について (表4)
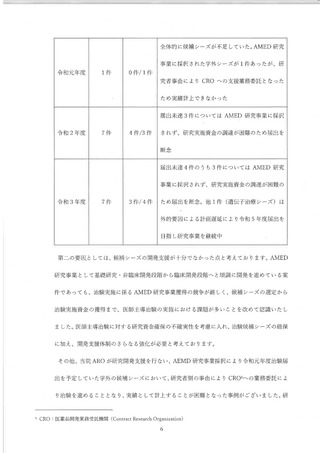
令和 3 年度 AMED 研究事業の獲得に至らなかった候補シーズのなかに、小規模で実施できる
探索的医師主導治験の案件があったことから、令和 4 年度の病院臨時支援策と して 3.000 万円規
模の予算編成を行い、治験計画の届出を行いました。令和 5 年度以降も同規模の治験候補シーズ
が見込まれることから、 研究資金獲得の不確実性も考慮し、 治験実施費用に対する支援策の継続
について検討を行い、 令和 5 年度以降についてもゃ探索的医師主導治験の支援を年 1 件程度継続す
のRS あと |また
また、薬事承認につながる医師主導治験の推進には、研究の裾野を広げる意味においても、臨
床研究法下に実施する上臨床研究の麗加も課題であると考えております。 臨床研究マネージャー連
HH
絡会議での研究者からのヒアリングにおいて、研究実施の障壁として研究費不足と CRB 審査並
びに申請手続きに係る負担が挙げられました。このようなかな点を考慮し、令和 5年度から臨床研究
法下の特定臨床研究に対して 1 件あたり 200 万円を上限と した支援制度の導入を決定しました。
令和 4 年度には機構職員が当該手続きを支援する取組みを試行し、 令和 5 年度からは本実施する
れらの取組みについては、継続的に実施むするとともに、不断の見次しと新たな対策の検討を講じ
るととで、治験シーズの更なる確保に努めて参ります。
支援体制の強化のため、令和 4 年度に臨床開発推進部門に6名 (製薬企業での研究開発業務経
験者1名 (教授)、 PMDA 審査業務経験者 1 名、他教員2名 (医師 1 名、 歯科医師 1 名)、スタデ
ィーマネージャー (以下、SM) 2 名) を採用しました。また、AMED 生物統計家育成支援事業
の大学修士課程修了者 2名を採用し、 生物統計家部門について$体制を強化しました。令和 5 年
度に2.(1) 2) 人材育成に係る取組みとして教員2名 (医師2名) を新たに採用する予定とし
ており、さらなる強化を図ります。
(2) 病院しての研究支援策等の拡充について (表4)
令和 3 年度 AMED 研究事業の獲得に至らなかった候補シーズのなかに、小規模で実施できる
探索的医師主導治験の案件があったことから、令和 4 年度の病院臨時支援策と して 3.000 万円規
模の予算編成を行い、治験計画の届出を行いました。令和 5 年度以降も同規模の治験候補シーズ
が見込まれることから、 研究資金獲得の不確実性も考慮し、 治験実施費用に対する支援策の継続
について検討を行い、 令和 5 年度以降についてもゃ探索的医師主導治験の支援を年 1 件程度継続す
のRS あと |また
また、薬事承認につながる医師主導治験の推進には、研究の裾野を広げる意味においても、臨
床研究法下に実施する上臨床研究の麗加も課題であると考えております。 臨床研究マネージャー連
HH
絡会議での研究者からのヒアリングにおいて、研究実施の障壁として研究費不足と CRB 審査並
びに申請手続きに係る負担が挙げられました。このようなかな点を考慮し、令和 5年度から臨床研究
法下の特定臨床研究に対して 1 件あたり 200 万円を上限と した支援制度の導入を決定しました。
令和 4 年度には機構職員が当該手続きを支援する取組みを試行し、 令和 5 年度からは本実施する