よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件に係る取扱いについて (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
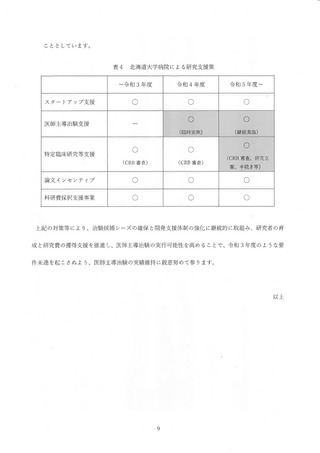
また、2021 年度「早期軽症の新型コロナウイルス感染症 (COVID-19) に対するナ
ファモスタットメシル酸塩のウイルス抑制効果及び安全性並びに至適用量を検討する
探索研究」についても医師主導治験で実施することを模索 したが、前述 した 2020 年度
「ファビビピラビルとナファモスタットメシル酸塩の併用療法の有効性を検討する特定
忠床研究」を開始した後に 国際
的な科学的、倫理的水準を満たし、信頼性が確認 し得る研究であれば承認申請に使う
ができる」 との清二412 9) 2た
ため、施設ごとに IRB 承認が必要な治験ではなく主施設での CRB 承認のみで多施設
Ri ooRにででSSに
実施するものの、ICH-GCP に準拠して実施することで、医師主導治験と同等の体制で
実施 した。
これら 2 試験は COVID-19 流行の特殊な事情により、特定了臨床研究と して実施した
ものの医師主導治験として実施できていれば、了臨床研究中核病院の要件を充足できて
いたものではあった。
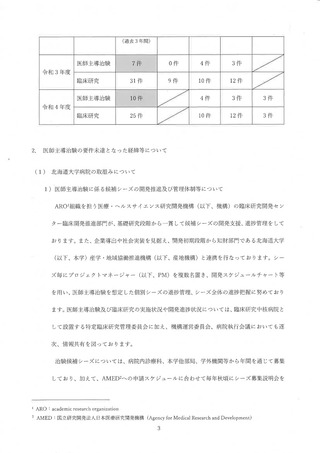
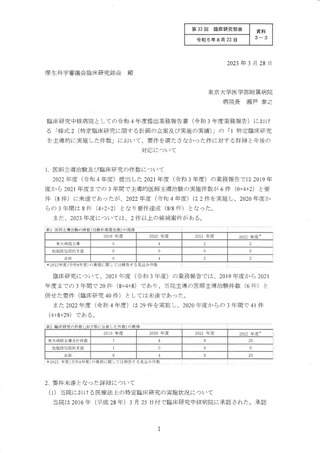
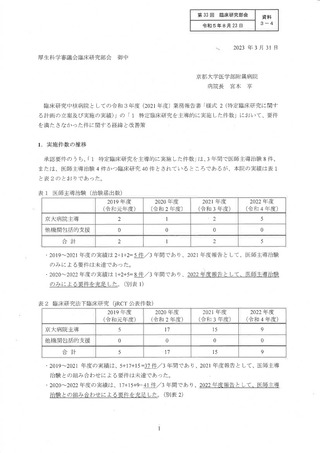
その他、2021 年度に治験届を提出できる可能性のあった候補と しては、表3 と表 4
に示すように、4 試験の候補があったが、いずれも表に記載したような事情により
2021 年度中に治験届を提出することができず、結果として、2 件不足 して要件を充足
できなかった。
こうした状況については、 間和 研究担当副院長
が参加する特定臨床研究運営委員会においても情報共有がなされてきており、病院幹
部も、了臨床研究 間 E性については危機意識を共有して
いた。 しかしながら、2020 年度、2021 年度は、COVID-19 の流行の波が繰り返され、
そうした中、医療体制についても COVID-19 の診療に関して、病院をあげて取り組む
ことが優先され、全国の国立大学病院でもトップクラスのCOVID-19 の診療を行う
中、また、既に実施している臨床研究以外の医学研究に関しても継続することが困難
な状況が続いており、新たに臨床研究の取り組みを要請することが困難な状況であっ
たことが、承認要件を充足できなかった要因としてあった。また、承認要件の「1 特
定了臨床研究を主導的に実施した件数」の「主導的な役割」のうち、「当該病院において
当該特定臨床研究の実施に関する業務を統括する責任者を定めた場合」の他に、「当該
病院が他の病院又は診療所に対し当該特定臨床研究の実施に関する包括的な支援を行
った場合」でもよいことの認識が不足しており、その取り組みが十分でなかったこと
も要因としてあげられる。
3、 今後の対応について
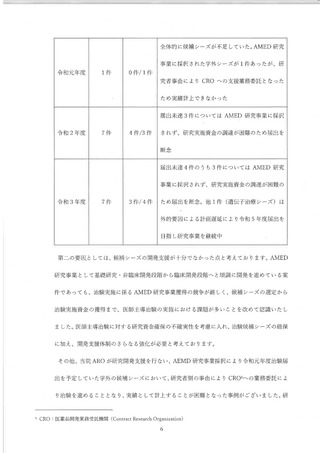
(1) 医療法上の特定臨床研究の活性化対策 WG の設置について
東大病院は国立大学病院データベースセンターの病院資料調査等により全国的な和観
ファモスタットメシル酸塩のウイルス抑制効果及び安全性並びに至適用量を検討する
探索研究」についても医師主導治験で実施することを模索 したが、前述 した 2020 年度
「ファビビピラビルとナファモスタットメシル酸塩の併用療法の有効性を検討する特定
忠床研究」を開始した後に 国際
的な科学的、倫理的水準を満たし、信頼性が確認 し得る研究であれば承認申請に使う
ができる」 との清二412 9) 2た
ため、施設ごとに IRB 承認が必要な治験ではなく主施設での CRB 承認のみで多施設
Ri ooRにででSSに
実施するものの、ICH-GCP に準拠して実施することで、医師主導治験と同等の体制で
実施 した。
これら 2 試験は COVID-19 流行の特殊な事情により、特定了臨床研究と して実施した
ものの医師主導治験として実施できていれば、了臨床研究中核病院の要件を充足できて
いたものではあった。
その他、2021 年度に治験届を提出できる可能性のあった候補と しては、表3 と表 4
に示すように、4 試験の候補があったが、いずれも表に記載したような事情により
2021 年度中に治験届を提出することができず、結果として、2 件不足 して要件を充足
できなかった。
こうした状況については、 間和 研究担当副院長
が参加する特定臨床研究運営委員会においても情報共有がなされてきており、病院幹
部も、了臨床研究 間 E性については危機意識を共有して
いた。 しかしながら、2020 年度、2021 年度は、COVID-19 の流行の波が繰り返され、
そうした中、医療体制についても COVID-19 の診療に関して、病院をあげて取り組む
ことが優先され、全国の国立大学病院でもトップクラスのCOVID-19 の診療を行う
中、また、既に実施している臨床研究以外の医学研究に関しても継続することが困難
な状況が続いており、新たに臨床研究の取り組みを要請することが困難な状況であっ
たことが、承認要件を充足できなかった要因としてあった。また、承認要件の「1 特
定了臨床研究を主導的に実施した件数」の「主導的な役割」のうち、「当該病院において
当該特定臨床研究の実施に関する業務を統括する責任者を定めた場合」の他に、「当該
病院が他の病院又は診療所に対し当該特定臨床研究の実施に関する包括的な支援を行
った場合」でもよいことの認識が不足しており、その取り組みが十分でなかったこと
も要因としてあげられる。
3、 今後の対応について
(1) 医療法上の特定臨床研究の活性化対策 WG の設置について
東大病院は国立大学病院データベースセンターの病院資料調査等により全国的な和観