よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件に係る取扱いについて (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
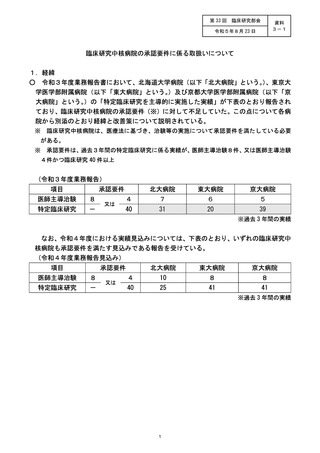
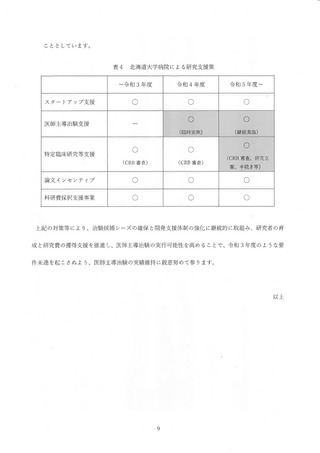
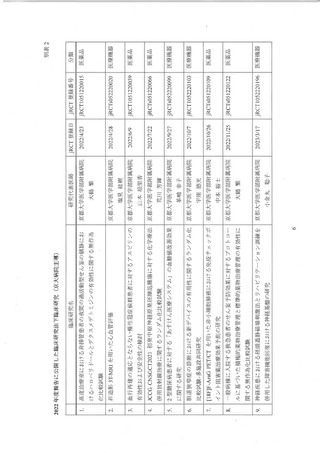
・7 月 13 日球行府間会議において、各診療科 (部) に対して協力依頼
・ 臨時臨床研究指導員研修会を複数回開催 して周知
・過去に臨床研究を実施 した実績の高い診療科から、順次、臨床研究推進センター
による個別の協力依頼
・臨床研究推進センターによる新規試験癌録までの支援強化及び試験実施に必要と
なる経費の支援
2) 中長期的に取り組むべき事項
・ 企業治験を含めて、WG で引き続き検討する
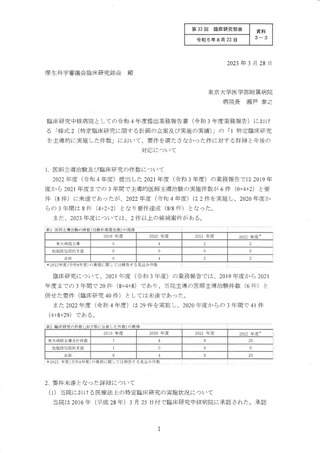
(3) 医療法上の特定臨床研究の活性化対策 WG の取り組みの進捗状況
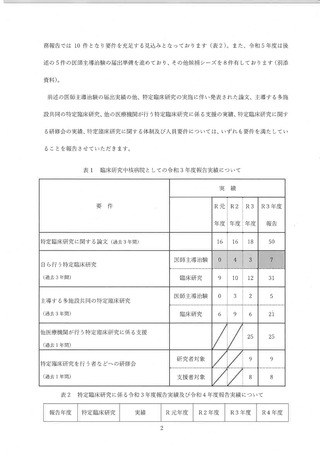
2 回の了莉時臨床研究指導貞研修会での説明を実施し、26 診療科への個別の説明会を
開催した (継続中)。
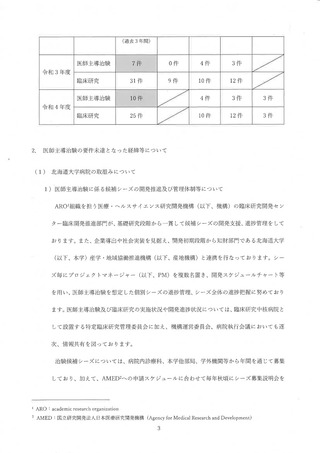
WG 説明会前からの案件 30 件) に加えて、WG 説明会後からの 77 件の案件が侯
補となった。107 件全てに対してガイダンス (ヒアリング) を実施し、2023 年度 3 月
末までにjRCT 登録が完了する可能性の高い案件から、コユンサルテーション (CRB 申
請の支援) を行った。2023 年 3 月末までに、合計 29 件の試験を 選CT へ登録した。
また、医師主導治験についても、2022 年 11 月 30 日に 1 件治験届を提出、更に
2023 年2月 20 日にも1件治験届を提出した。
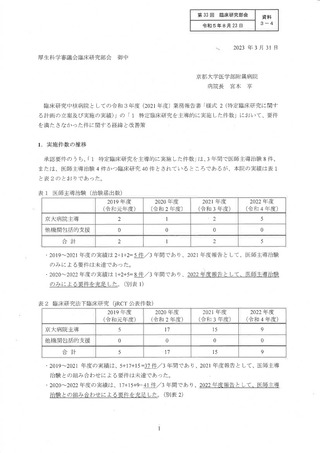
(4) 医療法上の特定臨床研究の活性化対策 WG の取り組みの継続について
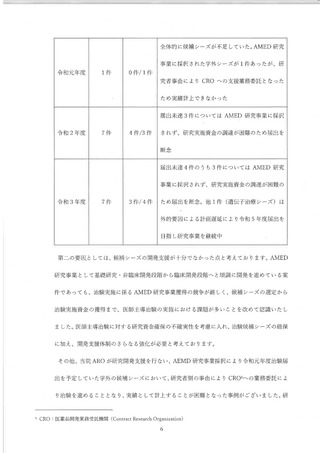
臨床研究中核病院の制度が発足した当時、その指定により、その名称を独占できる
ことによる、国際水準の質の高い臨床研究を行える病院としてアピールが可能である
ことがメリットとして掲げられ報道等を通じて周知されたが、特定機能病院と異な
り、現時点では了臨床研究中核病院の認定による診療報酬の加算等はなく、了臨床研究を
維持することの必要性については院内でも議論があった。そうした中、一部の政府系
大型事業の公募要件として 「隆床研究中核病院」の指定が求めりられているものが出現
し、今後、東大の研究者がそうした事業に応募するといった場合に、了臨床研究中核病
院の承認が取消となった場合のデメリット、影響が小さくないこと、また、東大病院
は了臨床医学の発展に努めることを理念に掲げ、先端的な医療の開発を目標にしている
ことからこそ引き続き、質の高い臨床研究を実施できる環境及び質の高い臨床研究を
支えるARO機能を維持するため、了臨床研究中核病院と しての認定要件を維持する必
要があり、東大病院における医療法上の特定臨床研究 (臨床研究法上の特定臨床研
究、医師主導治験、企業治験) の実施件数を安定的に維持するための対策を講じるこ
とが病院の方針と して決定された。
2022 年度は、まず、承認要件を充足するための対策を講じることに集中して取り組
・ 臨時臨床研究指導員研修会を複数回開催 して周知
・過去に臨床研究を実施 した実績の高い診療科から、順次、臨床研究推進センター
による個別の協力依頼
・臨床研究推進センターによる新規試験癌録までの支援強化及び試験実施に必要と
なる経費の支援
2) 中長期的に取り組むべき事項
・ 企業治験を含めて、WG で引き続き検討する
(3) 医療法上の特定臨床研究の活性化対策 WG の取り組みの進捗状況
2 回の了莉時臨床研究指導貞研修会での説明を実施し、26 診療科への個別の説明会を
開催した (継続中)。
WG 説明会前からの案件 30 件) に加えて、WG 説明会後からの 77 件の案件が侯
補となった。107 件全てに対してガイダンス (ヒアリング) を実施し、2023 年度 3 月
末までにjRCT 登録が完了する可能性の高い案件から、コユンサルテーション (CRB 申
請の支援) を行った。2023 年 3 月末までに、合計 29 件の試験を 選CT へ登録した。
また、医師主導治験についても、2022 年 11 月 30 日に 1 件治験届を提出、更に
2023 年2月 20 日にも1件治験届を提出した。
(4) 医療法上の特定臨床研究の活性化対策 WG の取り組みの継続について
臨床研究中核病院の制度が発足した当時、その指定により、その名称を独占できる
ことによる、国際水準の質の高い臨床研究を行える病院としてアピールが可能である
ことがメリットとして掲げられ報道等を通じて周知されたが、特定機能病院と異な
り、現時点では了臨床研究中核病院の認定による診療報酬の加算等はなく、了臨床研究を
維持することの必要性については院内でも議論があった。そうした中、一部の政府系
大型事業の公募要件として 「隆床研究中核病院」の指定が求めりられているものが出現
し、今後、東大の研究者がそうした事業に応募するといった場合に、了臨床研究中核病
院の承認が取消となった場合のデメリット、影響が小さくないこと、また、東大病院
は了臨床医学の発展に努めることを理念に掲げ、先端的な医療の開発を目標にしている
ことからこそ引き続き、質の高い臨床研究を実施できる環境及び質の高い臨床研究を
支えるARO機能を維持するため、了臨床研究中核病院と しての認定要件を維持する必
要があり、東大病院における医療法上の特定臨床研究 (臨床研究法上の特定臨床研
究、医師主導治験、企業治験) の実施件数を安定的に維持するための対策を講じるこ
とが病院の方針と して決定された。
2022 年度は、まず、承認要件を充足するための対策を講じることに集中して取り組