よむ、つかう、まなぶ。
03【資料1-1】新型コロナワクチンの接種について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31559.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第45回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
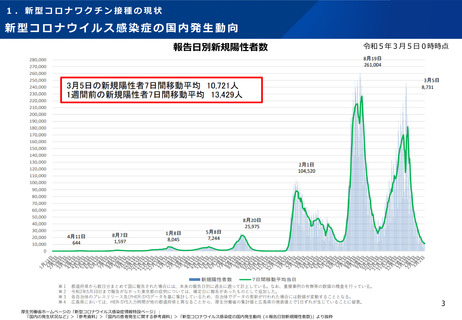
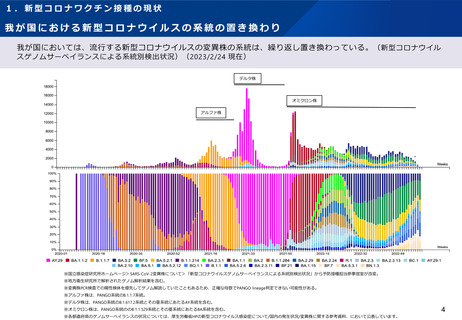
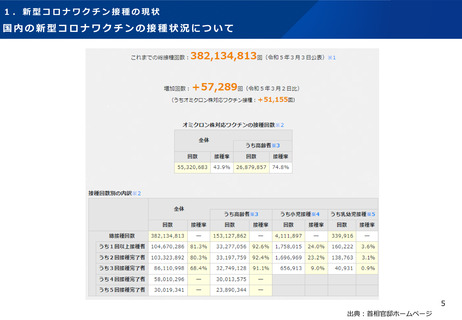
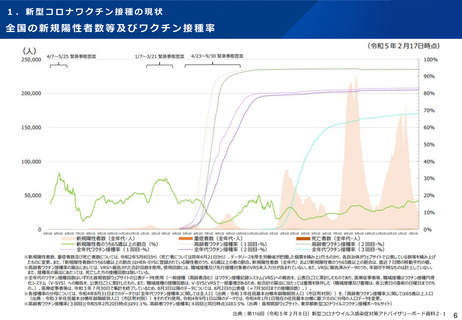
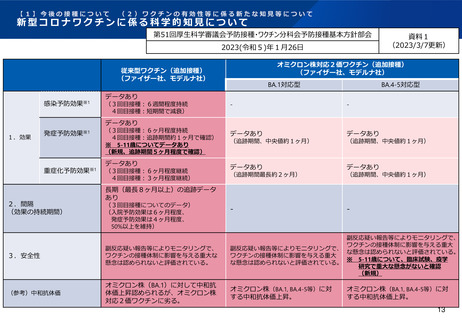
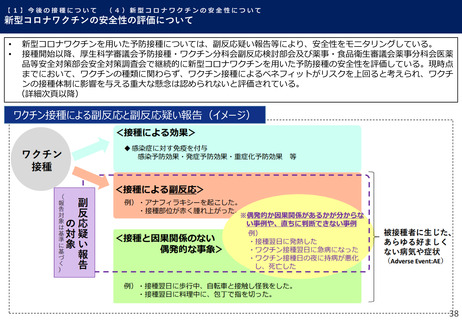
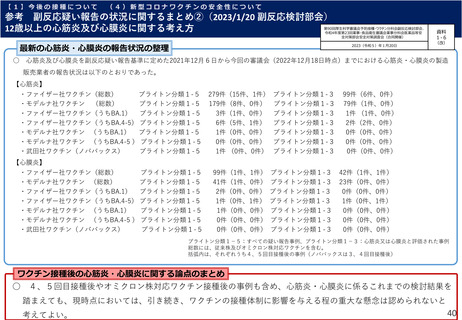
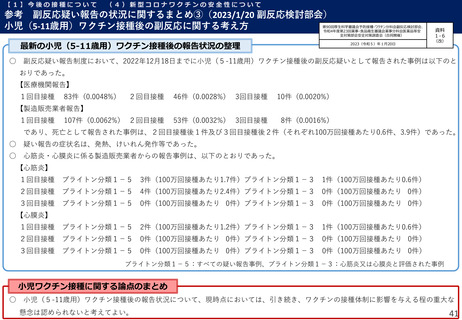
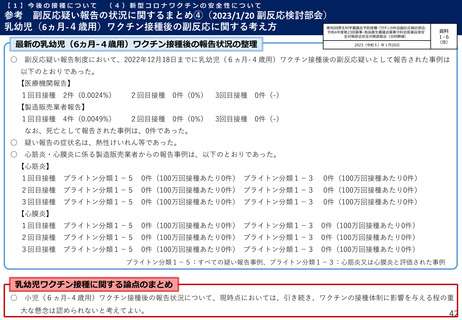
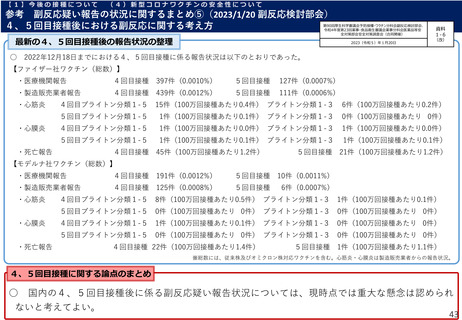
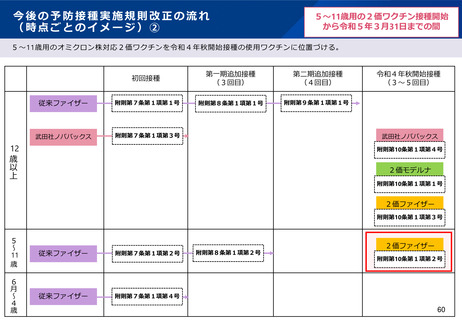
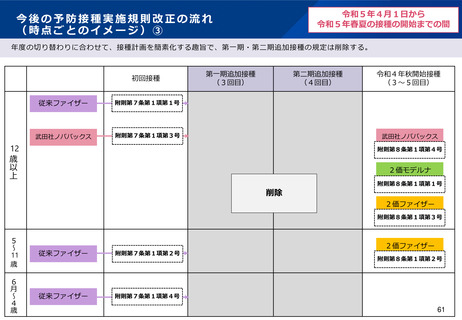
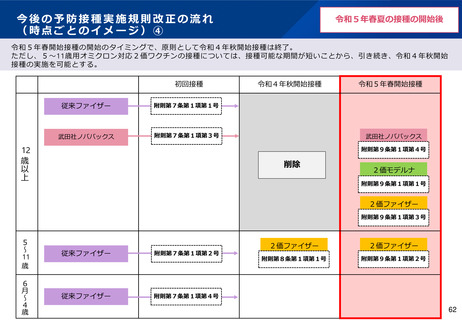
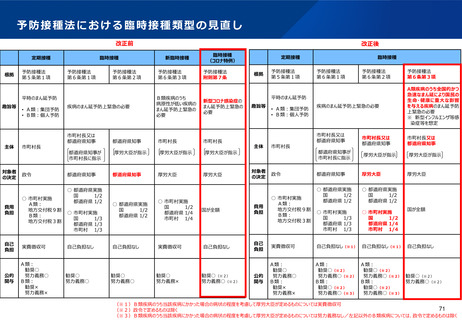
【1】今後の接種について
(3)小児に対する接種について
①
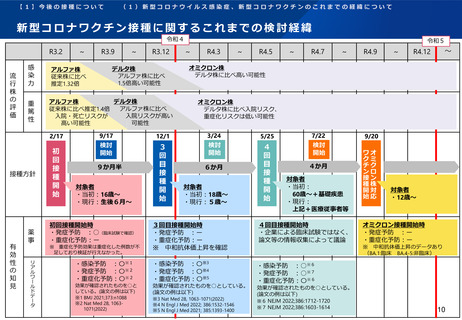
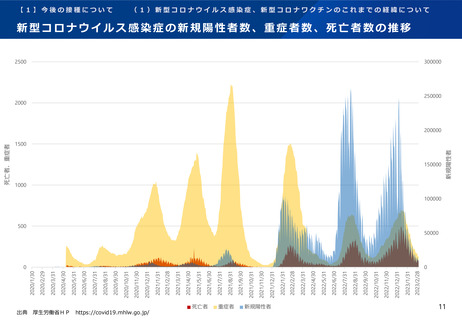
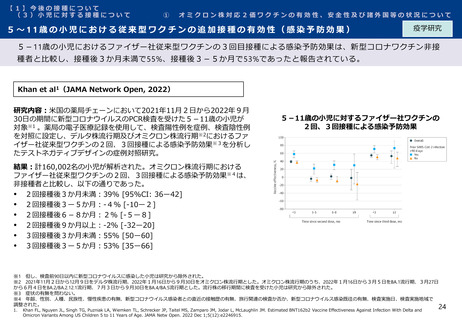
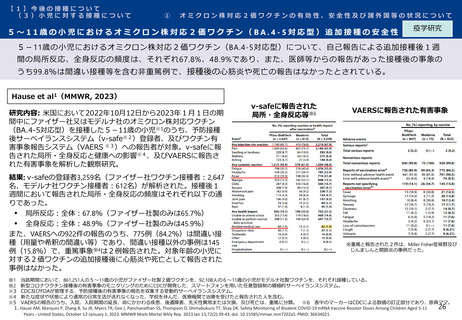
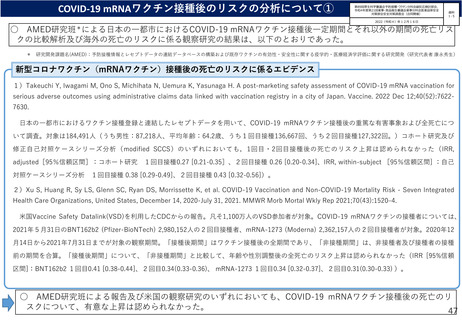
オミクロン株対応2価ワクチンの有効性、安全性及び諸外国等の状況について
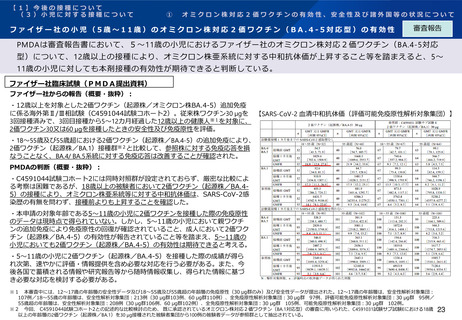
ファイザー社の小児(5歳~11歳)のオミクロン株対応2価ワクチン(BA.4-5対応型)の安全性
審査報告
PMDAは審査報告書において、5~11歳の小児におけるファイザー社のオミクロン株対応2価ワクチン(BA.4-5対応
型)について、従来型ワクチン(親ワクチン)の安全性と概ね同様と評価している。
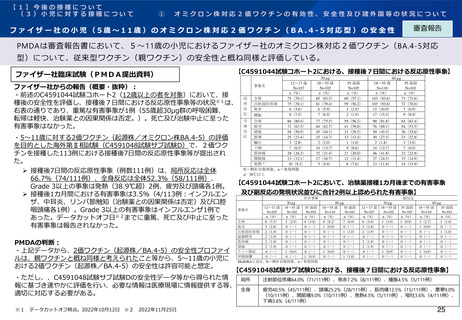
ファイザー社臨床試験(PMDA提出資料)
【C4591044試験コホート2における、接種後7日間における反応原性事象】
ファイザー社からの報告(概要・抜粋):
・前述のC4591044試験コホート2(12歳以上の者を対象)において、接
種後の安全性を評価し、接種後7日間における反応原性事象等の状況※1は、
右表の通りであり、重篤な有害事象が1例(55歳超30μg群の呼吸困難、
転帰は軽快、治験薬との因果関係は否定。)。死亡及び治験中止に至った
有害事象はなかった。
事象名
局
所
反
応
全
身
反
応
全体
注射部位疼痛
発赤
腫脹
12~17 歳
N=107
n(%)
75(70.1)
75(70.1)
6(5.6)
8(7.5)
全体
86(80.4)
疲労
72(67.3)
頭痛
54(50.5)
悪寒
25(23.4)
嘔吐
3(2.8)
下痢
7(6.5)
筋肉痛
28(26.2)
関節痛
13(12.1)
発熱 a)
10(9.3)
N=解析対象例数、n=発現例数
a)38℃以上
30 µg
18~55 歳
N=102
n(%)
85(83.3)
81(79.4)
6(5.9)
7(6.9)
55 歳超
N=105
n(%)
60(57.1)
59(56.2)
3(2.9)
2(1.9)
60 µg
18~55 歳
55 歳超
N=110
N=101
n(%)
n(%)
103(93.6)
73(71.6)
103(93.6)
72(70.6)
12(10.9)
7(6.9)
17(15.5)
9(8.9)
77(75.5)
64(62.7)
45(44.1)
15(14.7)
2(2.0)
14(13.7)
32(31.4)
17(16.7)
5(4.9)
59(56.2)
41(39.0)
31(29.5)
13(12.4)
1(1.0)
9(8.6)
21(20.0)
12(11.4)
8(7.6)
90(81.8)
76(69.1)
50(45.5)
30(27.3)
2(1.8)
14(12.7)
46(41.8)
27(24.5)
13(11.8)
64(63.4)
54(53.5)
36(35.6)
23(22.8)
3(3.0)
7(6.9)
23(22.8)
15(14.9)
14(13.9)
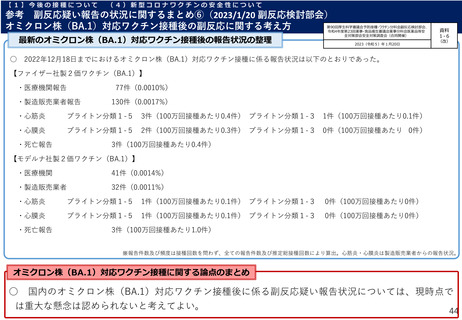
・5~11歳に対する2価ワクチン(起源株/オミクロン株BA.4-5)の評価
を目的とした海外第Ⅱ相試験(C4591048試験サブ試験D)で、2価ワク
チンを接種した113例における接種後7日間の反応原性事象等が提出され
た。
➢ 接種後7日間の反応原性事象(例数111例)は、局所反応は全体
66.7%(74/111例)、全身反応は全体52.3%(58/111例)、
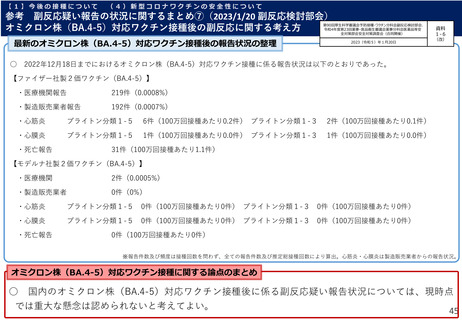
【C4591044試験コホート2において、治験薬接種1カ月後までの有害事象
Grade 3以上の事象は発熱(38.9℃超)2例、疲労及び頭痛各1例。
及び副反応の発現状況並びに合計2例以上認められた有害事象】
➢ 接種後1カ月間における有害事象は3.5%(4/113例:インフルエン
有害事象
副反応
30 µg
60 µg
30 µg
60 µg
ザ、中耳炎、リンパ節触知(治験薬との因果関係は否定)及び口腔
12~17 歳 18~55 歳 55 歳超 18~55 歳
55 歳超
12~17 歳 18~55 歳 55 歳超 18~55 歳
55 歳超
事象名
咽頭痛各1例)。Grade 3以上の有害事象はインフルエンザ1例で
N=107
N=102
N=105
N=110
N=101
N=107
N=102
N=105
N=110
N=101
※2
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
あった。データカットオフ日 までに重篤、死亡及び中止に至った 全体
8(7.5)
3(2.9) 4(3.8) 9(8.2)
7(6.9)
6(5.6)
1(1.0) 1(0.9) 3(2.7)
1(1.0)
有害事象は報告されなかった。
疲労
3(2.8)
0(-)
0(-)
1(0.9)
0(-)
3(2.8)
0(-)
0(-)
1(0.9)
0(-)
PMDAの判断:
・上記データから、2価ワクチン(起源株/BA.4-5)の安全性プロファイ
ルは、親ワクチンと概ね同様と考えられたこと等から、5~11歳の小児に
おける2価ワクチン(起源株/BA.4-5)の安全性は許容可能と想定。
注射部位疼痛 2(1.9)
0(-)
0(-)
副鼻腔炎
2(1.9)
0(-)
0(-)
筋肉痛
2(1.9)
0(-)
0(-)
頭痛
2(1.9)
0(-)
0(-)
リンパ節症
0(-)
1(0.9)
0(-)
呼吸困難
0(-)
0(-)
1(0.9)
MedDRA v 25.0、N=解析対象例数、n=発現例数
1(1.0)
0(-)
0(-)
0(-)
0(-)
1(1.0)
2(1.9)
0(-)
2(1.9)
2(1.9)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
1(0.9)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
1(0.9)
0(-)
1(1.0)
0(-)
0(-)
0(-)
0(-)
0(-)
【C4591048試験サブ試験Dにおける、接種後7日間における反応原性事象】
・ただし、、C4591048試験サブ試験Dの安全性データ等から得られた情
報に基づき速やかに評価を行い、必要な情報は医療現場に情報提供する等、
適切に対応する必要がある。
※1 データカットオフ時点。2022年10月12日 ※2 2022年11月25日
0(-)
0(-)
0(-)
0(-)
1(0.9)
0(-)
局所
注射部位疼痛64.0%(71/111例)、発赤7.2%(8/111例)、腫脹4.5%(5/111例)
全身
疲労40.5%(45/111例)、頭痛25.2%(28/111例)、筋肉痛13.5%(15/111例)、悪寒9.0%
(10/111例)、関節痛9.0%(10/111例)、発熱4.5%(5/111例)、嘔吐3.6%(4/111例)、
下痢3.6%(4/111例)
25
(3)小児に対する接種について
①
オミクロン株対応2価ワクチンの有効性、安全性及び諸外国等の状況について
ファイザー社の小児(5歳~11歳)のオミクロン株対応2価ワクチン(BA.4-5対応型)の安全性
審査報告
PMDAは審査報告書において、5~11歳の小児におけるファイザー社のオミクロン株対応2価ワクチン(BA.4-5対応
型)について、従来型ワクチン(親ワクチン)の安全性と概ね同様と評価している。
ファイザー社臨床試験(PMDA提出資料)
【C4591044試験コホート2における、接種後7日間における反応原性事象】
ファイザー社からの報告(概要・抜粋):
・前述のC4591044試験コホート2(12歳以上の者を対象)において、接
種後の安全性を評価し、接種後7日間における反応原性事象等の状況※1は、
右表の通りであり、重篤な有害事象が1例(55歳超30μg群の呼吸困難、
転帰は軽快、治験薬との因果関係は否定。)。死亡及び治験中止に至った
有害事象はなかった。
事象名
局
所
反
応
全
身
反
応
全体
注射部位疼痛
発赤
腫脹
12~17 歳
N=107
n(%)
75(70.1)
75(70.1)
6(5.6)
8(7.5)
全体
86(80.4)
疲労
72(67.3)
頭痛
54(50.5)
悪寒
25(23.4)
嘔吐
3(2.8)
下痢
7(6.5)
筋肉痛
28(26.2)
関節痛
13(12.1)
発熱 a)
10(9.3)
N=解析対象例数、n=発現例数
a)38℃以上
30 µg
18~55 歳
N=102
n(%)
85(83.3)
81(79.4)
6(5.9)
7(6.9)
55 歳超
N=105
n(%)
60(57.1)
59(56.2)
3(2.9)
2(1.9)
60 µg
18~55 歳
55 歳超
N=110
N=101
n(%)
n(%)
103(93.6)
73(71.6)
103(93.6)
72(70.6)
12(10.9)
7(6.9)
17(15.5)
9(8.9)
77(75.5)
64(62.7)
45(44.1)
15(14.7)
2(2.0)
14(13.7)
32(31.4)
17(16.7)
5(4.9)
59(56.2)
41(39.0)
31(29.5)
13(12.4)
1(1.0)
9(8.6)
21(20.0)
12(11.4)
8(7.6)
90(81.8)
76(69.1)
50(45.5)
30(27.3)
2(1.8)
14(12.7)
46(41.8)
27(24.5)
13(11.8)
64(63.4)
54(53.5)
36(35.6)
23(22.8)
3(3.0)
7(6.9)
23(22.8)
15(14.9)
14(13.9)
・5~11歳に対する2価ワクチン(起源株/オミクロン株BA.4-5)の評価
を目的とした海外第Ⅱ相試験(C4591048試験サブ試験D)で、2価ワク
チンを接種した113例における接種後7日間の反応原性事象等が提出され
た。
➢ 接種後7日間の反応原性事象(例数111例)は、局所反応は全体
66.7%(74/111例)、全身反応は全体52.3%(58/111例)、
【C4591044試験コホート2において、治験薬接種1カ月後までの有害事象
Grade 3以上の事象は発熱(38.9℃超)2例、疲労及び頭痛各1例。
及び副反応の発現状況並びに合計2例以上認められた有害事象】
➢ 接種後1カ月間における有害事象は3.5%(4/113例:インフルエン
有害事象
副反応
30 µg
60 µg
30 µg
60 µg
ザ、中耳炎、リンパ節触知(治験薬との因果関係は否定)及び口腔
12~17 歳 18~55 歳 55 歳超 18~55 歳
55 歳超
12~17 歳 18~55 歳 55 歳超 18~55 歳
55 歳超
事象名
咽頭痛各1例)。Grade 3以上の有害事象はインフルエンザ1例で
N=107
N=102
N=105
N=110
N=101
N=107
N=102
N=105
N=110
N=101
※2
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
あった。データカットオフ日 までに重篤、死亡及び中止に至った 全体
8(7.5)
3(2.9) 4(3.8) 9(8.2)
7(6.9)
6(5.6)
1(1.0) 1(0.9) 3(2.7)
1(1.0)
有害事象は報告されなかった。
疲労
3(2.8)
0(-)
0(-)
1(0.9)
0(-)
3(2.8)
0(-)
0(-)
1(0.9)
0(-)
PMDAの判断:
・上記データから、2価ワクチン(起源株/BA.4-5)の安全性プロファイ
ルは、親ワクチンと概ね同様と考えられたこと等から、5~11歳の小児に
おける2価ワクチン(起源株/BA.4-5)の安全性は許容可能と想定。
注射部位疼痛 2(1.9)
0(-)
0(-)
副鼻腔炎
2(1.9)
0(-)
0(-)
筋肉痛
2(1.9)
0(-)
0(-)
頭痛
2(1.9)
0(-)
0(-)
リンパ節症
0(-)
1(0.9)
0(-)
呼吸困難
0(-)
0(-)
1(0.9)
MedDRA v 25.0、N=解析対象例数、n=発現例数
1(1.0)
0(-)
0(-)
0(-)
0(-)
1(1.0)
2(1.9)
0(-)
2(1.9)
2(1.9)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
1(0.9)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
0(-)
1(0.9)
0(-)
1(1.0)
0(-)
0(-)
0(-)
0(-)
0(-)
【C4591048試験サブ試験Dにおける、接種後7日間における反応原性事象】
・ただし、、C4591048試験サブ試験Dの安全性データ等から得られた情
報に基づき速やかに評価を行い、必要な情報は医療現場に情報提供する等、
適切に対応する必要がある。
※1 データカットオフ時点。2022年10月12日 ※2 2022年11月25日
0(-)
0(-)
0(-)
0(-)
1(0.9)
0(-)
局所
注射部位疼痛64.0%(71/111例)、発赤7.2%(8/111例)、腫脹4.5%(5/111例)
全身
疲労40.5%(45/111例)、頭痛25.2%(28/111例)、筋肉痛13.5%(15/111例)、悪寒9.0%
(10/111例)、関節痛9.0%(10/111例)、発熱4.5%(5/111例)、嘔吐3.6%(4/111例)、
下痢3.6%(4/111例)
25