よむ、つかう、まなぶ。
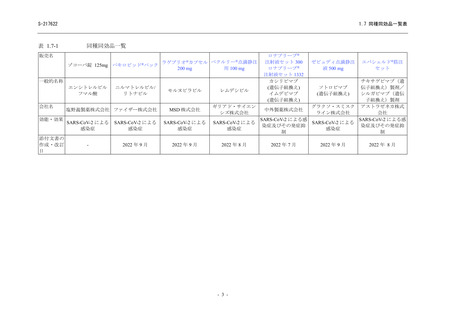
【資料No.1】1.7_同種同効品一覧表 (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2)社内資料:国内第I
相試験(D8850C00005試験)
(2022年8月
18.
3 耐性
30日承認、
CTD2.
7.
6.
2.
1)
18.
3.
1非臨床試験成績
3)社内資料:AZD7442の薬物動態(消失)
( 2022年8月30日承
SARSCoV2又はSARSCoV2のスパイクタンパク質を発現す
認、
CTD2.
7.
2.
3.
1.
5)
る組換え水疱性口内炎ウイルスをチキサゲビマブ及びシルガビマ
社内資料:国際共同第I
I
I
相試験(TACKLE試験)
4)
(2022年8月
ブ併用下で継代培養したところ逃避変異は同定されなかっ
16)
た15),
。
30日承認、
治療CTD2.
7.
6.
2.
2)
5)W H O W orking G roup on the C linical
18.
3.
2臨床試験成績
TACKLE試験において、ベースライン時点及び治験薬投与後にお
Char
act
er
i
sat
i
on and ManagementofCOVI
D19
けるSARSCoV2スパイクタンパク質の塩基配列データが得ら
i
nf
ect
i
on.LancetI
nf
ectDi
s
.2020;
20(
8)
:
e1927
れた本剤群の18例のうち、6例で本剤投与後にアレル頻度3%以上
6)Levi
n MJ
,etal
.N EnglJMed.2022;
386(
23)
:
2188200
の新たな変異が計35種類認められた。そのうち16種類の変異をそ
7)
社内資料:海外第I
I
I
相試験(STORM CHASER試験)
(2022
年8月30日承認、
CTD2.
7.
6.
2.
4)
れぞれ有するシュードウイルス粒子に対して、チキサゲビマブ及
8)
Loo YM,etal
.SciTr
ans
lMed.2022;
eabl
8124
びシルガビマブ併用の中和活性が検討され、EC50は野生型の10倍
9)Zos
.Nat
ur
e.2020;
584(
7821)
:
4439.
tSJ
,etal
未満であった4)。
10)
社内資料:結合キネティクスと作用機序(MCBS74420001
19.有効成分に関する理化学的知見
試験)
(2022年8月30日承認、
CTD2.
6.
2.
2.
1)
19.
1 チキサゲビマブ(遺伝子組換え)
11)
社 内 資 料 : Fcの TM置 換 に よ る Fcエ フ ェ ク タ ー 機 能 低 下
一般的名称
( M CBS7442-0007試 験 )
( 2022年 8月 30日 承 認 、
チキサゲビマブ(遺伝子組換え)
(J
AN)
CTD2.
6.
2.
2.
9)
Ti
xagevi
mab (
Genet
i
calRecombi
nat
i
on)
CoV2に対する中和活性(MCBS744212)社内資料:SARS-
本質
0003試験)
(2022年8月30日承認、
CTD2.
6.
2.
2.
5)
チキサゲビマブは、
遺伝子組換え抗SARSCoV2スパイクタンパ
13)
社内資料:Ant
i
vi
r
alRes
i
s
t
anceI
nf
or
mat
i
on
(2022年8月
ク質モノクローナル抗体であり、
ヒトI
gG1に由来する。
H鎖の
30日承認、
CTD2.
6.
2.
2.
10.
1、
CTD2.
6.
2.
2.
10.
3)
240、241、258、260、262及び337番目のアミノ酸残基は、
それぞ
14)社内資料:Omi
cr
on株に対する中和活性
れPhe、Gl
u、
Tyr
、Thr
、
Gl
u及びSer
に置換されている。
チキサゲビ
15)社内資料:耐性に関連するアミノ酸置換の特定を目的とした
チキ
マブは、
チャイニーズハムスター卵巣細胞により産生される。
中和作用に対するエスケープ変異株の検出(MCBS7442-
サゲビマブは、461個のアミノ酸残基からなるH鎖
(γ1鎖)
2本及
0010試験)
(2022年8月30日承認、
CTD2.
6.
2.
2.
10.
2)
び216個のアミノ酸残基からなるL鎖
(κ鎖)
2本で構成される糖タ
16)
DongJ
,etal
.Nat
ur
eMi
cr
obi
ol
ogy.2021;
6:
123344.
ンパク質
(分子量:約149,
000)
である。
24.文献請求先及び問い合わせ先
19.
2 シルガビマブ(遺伝子組換え)
アストラゼネカ株式会社 メディカルインフォメーションセンター
一般的名称
シルガビマブ(遺伝子組換え)
(J
AN)
〒5300011 大阪市北区大深町3番1号
Ci
l
gavi
mab (
Genet
i
calRecombi
nat
i
on)
TEL 0120189115
ht
t
ps
:
/
/
www.
as
t
r
azeneca.
co.
j
p
本質
シルガビマブは、遺伝子組換え抗SARSCoV2スパイクタンパク
質モノクローナル抗体であり、
ヒトI
gG1に由来する。
H 鎖の248、
26.製造販売業者等
26.
1 製造販売元
それぞれ
249、266、268、270及び345番目のアミノ酸残基は、
Phe、
Gl
u、
Tyr
、Thr
、
Gl
u及びSer
に置換されている。
シルガビマブ
は、チャイニーズハムスター卵巣細胞により産生される。
シルガビ
マブは、461個のアミノ酸残基からなるH鎖
(γ1鎖)
2本及び219
個のアミノ酸残基からなるL鎖
(κ鎖)
2本で構成される糖タンパ
ク質(分子量:約152,
000)
である。
20.取扱い上の注意
20.
1凍結を避けること。
凍結した場合は使用しないこと。
20.
2外箱開封後は遮光して保存すること。
21.承認条件
21.
1医薬品リスク管理計画を策定の上、
適切に実施すること。
21.
2新規変異株の流行が懸念される場合、当該変異株に対する中和
活性等を速やかに検討し、
その結果を厚生労働省に提出すること。
21.
3本剤の有効性が減弱するおそれがある変異株が流行している
場合は、新規変異株に対する中和活性、新規変異株の地域ごとの流
行状況等を踏まえ、適切な患者に対して投与するよう医師に対し
て要請するなど、本剤の適正な使用が確保されるよう必要な措置
を講じること。
22.包装
チキサゲビマブ製剤1.
5mL×1バイアル及び
シルガビマブ製剤1.
5mL×1バイアル
23.主要文献
1)社内資料:海外第I
相試験(D8850C00001試験)
(2022年8月
30日承認、CTD2.
7.
6.
2.
2)
−5−
相試験(D8850C00005試験)
(2022年8月
18.
3 耐性
30日承認、
CTD2.
7.
6.
2.
1)
18.
3.
1非臨床試験成績
3)社内資料:AZD7442の薬物動態(消失)
( 2022年8月30日承
SARSCoV2又はSARSCoV2のスパイクタンパク質を発現す
認、
CTD2.
7.
2.
3.
1.
5)
る組換え水疱性口内炎ウイルスをチキサゲビマブ及びシルガビマ
社内資料:国際共同第I
I
I
相試験(TACKLE試験)
4)
(2022年8月
ブ併用下で継代培養したところ逃避変異は同定されなかっ
16)
た15),
。
30日承認、
治療CTD2.
7.
6.
2.
2)
5)W H O W orking G roup on the C linical
18.
3.
2臨床試験成績
TACKLE試験において、ベースライン時点及び治験薬投与後にお
Char
act
er
i
sat
i
on and ManagementofCOVI
D19
けるSARSCoV2スパイクタンパク質の塩基配列データが得ら
i
nf
ect
i
on.LancetI
nf
ectDi
s
.2020;
20(
8)
:
e1927
れた本剤群の18例のうち、6例で本剤投与後にアレル頻度3%以上
6)Levi
n MJ
,etal
.N EnglJMed.2022;
386(
23)
:
2188200
の新たな変異が計35種類認められた。そのうち16種類の変異をそ
7)
社内資料:海外第I
I
I
相試験(STORM CHASER試験)
(2022
年8月30日承認、
CTD2.
7.
6.
2.
4)
れぞれ有するシュードウイルス粒子に対して、チキサゲビマブ及
8)
Loo YM,etal
.SciTr
ans
lMed.2022;
eabl
8124
びシルガビマブ併用の中和活性が検討され、EC50は野生型の10倍
9)Zos
.Nat
ur
e.2020;
584(
7821)
:
4439.
tSJ
,etal
未満であった4)。
10)
社内資料:結合キネティクスと作用機序(MCBS74420001
19.有効成分に関する理化学的知見
試験)
(2022年8月30日承認、
CTD2.
6.
2.
2.
1)
19.
1 チキサゲビマブ(遺伝子組換え)
11)
社 内 資 料 : Fcの TM置 換 に よ る Fcエ フ ェ ク タ ー 機 能 低 下
一般的名称
( M CBS7442-0007試 験 )
( 2022年 8月 30日 承 認 、
チキサゲビマブ(遺伝子組換え)
(J
AN)
CTD2.
6.
2.
2.
9)
Ti
xagevi
mab (
Genet
i
calRecombi
nat
i
on)
CoV2に対する中和活性(MCBS744212)社内資料:SARS-
本質
0003試験)
(2022年8月30日承認、
CTD2.
6.
2.
2.
5)
チキサゲビマブは、
遺伝子組換え抗SARSCoV2スパイクタンパ
13)
社内資料:Ant
i
vi
r
alRes
i
s
t
anceI
nf
or
mat
i
on
(2022年8月
ク質モノクローナル抗体であり、
ヒトI
gG1に由来する。
H鎖の
30日承認、
CTD2.
6.
2.
2.
10.
1、
CTD2.
6.
2.
2.
10.
3)
240、241、258、260、262及び337番目のアミノ酸残基は、
それぞ
14)社内資料:Omi
cr
on株に対する中和活性
れPhe、Gl
u、
Tyr
、Thr
、
Gl
u及びSer
に置換されている。
チキサゲビ
15)社内資料:耐性に関連するアミノ酸置換の特定を目的とした
チキ
マブは、
チャイニーズハムスター卵巣細胞により産生される。
中和作用に対するエスケープ変異株の検出(MCBS7442-
サゲビマブは、461個のアミノ酸残基からなるH鎖
(γ1鎖)
2本及
0010試験)
(2022年8月30日承認、
CTD2.
6.
2.
2.
10.
2)
び216個のアミノ酸残基からなるL鎖
(κ鎖)
2本で構成される糖タ
16)
DongJ
,etal
.Nat
ur
eMi
cr
obi
ol
ogy.2021;
6:
123344.
ンパク質
(分子量:約149,
000)
である。
24.文献請求先及び問い合わせ先
19.
2 シルガビマブ(遺伝子組換え)
アストラゼネカ株式会社 メディカルインフォメーションセンター
一般的名称
シルガビマブ(遺伝子組換え)
(J
AN)
〒5300011 大阪市北区大深町3番1号
Ci
l
gavi
mab (
Genet
i
calRecombi
nat
i
on)
TEL 0120189115
ht
t
ps
:
/
/
www.
as
t
r
azeneca.
co.
j
p
本質
シルガビマブは、遺伝子組換え抗SARSCoV2スパイクタンパク
質モノクローナル抗体であり、
ヒトI
gG1に由来する。
H 鎖の248、
26.製造販売業者等
26.
1 製造販売元
それぞれ
249、266、268、270及び345番目のアミノ酸残基は、
Phe、
Gl
u、
Tyr
、Thr
、
Gl
u及びSer
に置換されている。
シルガビマブ
は、チャイニーズハムスター卵巣細胞により産生される。
シルガビ
マブは、461個のアミノ酸残基からなるH鎖
(γ1鎖)
2本及び219
個のアミノ酸残基からなるL鎖
(κ鎖)
2本で構成される糖タンパ
ク質(分子量:約152,
000)
である。
20.取扱い上の注意
20.
1凍結を避けること。
凍結した場合は使用しないこと。
20.
2外箱開封後は遮光して保存すること。
21.承認条件
21.
1医薬品リスク管理計画を策定の上、
適切に実施すること。
21.
2新規変異株の流行が懸念される場合、当該変異株に対する中和
活性等を速やかに検討し、
その結果を厚生労働省に提出すること。
21.
3本剤の有効性が減弱するおそれがある変異株が流行している
場合は、新規変異株に対する中和活性、新規変異株の地域ごとの流
行状況等を踏まえ、適切な患者に対して投与するよう医師に対し
て要請するなど、本剤の適正な使用が確保されるよう必要な措置
を講じること。
22.包装
チキサゲビマブ製剤1.
5mL×1バイアル及び
シルガビマブ製剤1.
5mL×1バイアル
23.主要文献
1)社内資料:海外第I
相試験(D8850C00001試験)
(2022年8月
30日承認、CTD2.
7.
6.
2.
2)
−5−